
导读 软脑膜转移(LM)在非小细胞肺癌(NSCLC)患者中的发生率为3-5%,在EGFR突变的患者中可高达约9%。靶向治疗的患者总生存期最高仅为12个月且治疗选择非常有限。近年来,免疫检查点抑制剂(ICIs)在治疗非小细胞肺癌患者方面取得了显著进展,几种PD-1/PD-L1抑制剂已获批准用于转移性非小细胞肺癌的治疗并表现出了良好的疗效。同时,研究发现ICIs在部分脑实质转移的肺癌和黑色素瘤患者中疗效较好,然而ICIs对LM患者的疗效信息研究较少。
近日,广东省肺癌研究所吴一龙教授团队探究了免疫检查点抑制剂(ICIs)对LM患者生存的影响,揭示了LM NSCLC患者可能从ICIs单药或联合治疗中获益,脑脊液ctDNA检测可作为颅内免疫治疗疗效监测方法,为LM NSCLC患者的治疗提供了新方向。世和基因参与研究负责NGS检测,相关研究成果发表于European Journal of Cancer(IF=7.275)。



正文 本研究回顾了2015年1月至2020年3月在广东省肺癌研究所诊断为脑膜转移的255例NSCLC患者,其中7例患者接受了免疫单药或联合治疗。同时还系统地检索了2012年1月至2020年3月PubMed/Cochrane/EMBASE数据库中的文献,进一步发现了25例LM NSCLC患者免疫治疗数据。最终纳入分析32例患者,免疫治疗开始后的中位随访时间至少13个月。 人群特征
32例患者的临床特征见表1,中位年龄55岁(34-80岁),13例为男性(40.6%),2/3的患者具有吸烟史。患者中28例为肺腺癌,4例为肺鳞癌。15例(46.8%)患者有PD-L1表达数据,其中6例(18.8%)患者PD-L1表达水平超过80%。在接受免疫治疗时,81.2%的患者同时有脑转移。13例患者脑脊液中检出肿瘤细胞,28例脑部影像学表现为典型的LM,患者#5因脑脊液中检测到EGFR突变和严重的神经系统症状被诊断为LM。2/3患者在治疗前主诉视力障碍、头痛、记忆丧失等。12例患者(37.5%)存在驱动基因突变(EGFR/ALK/BRAF/MET/ ERBB2,图1)。
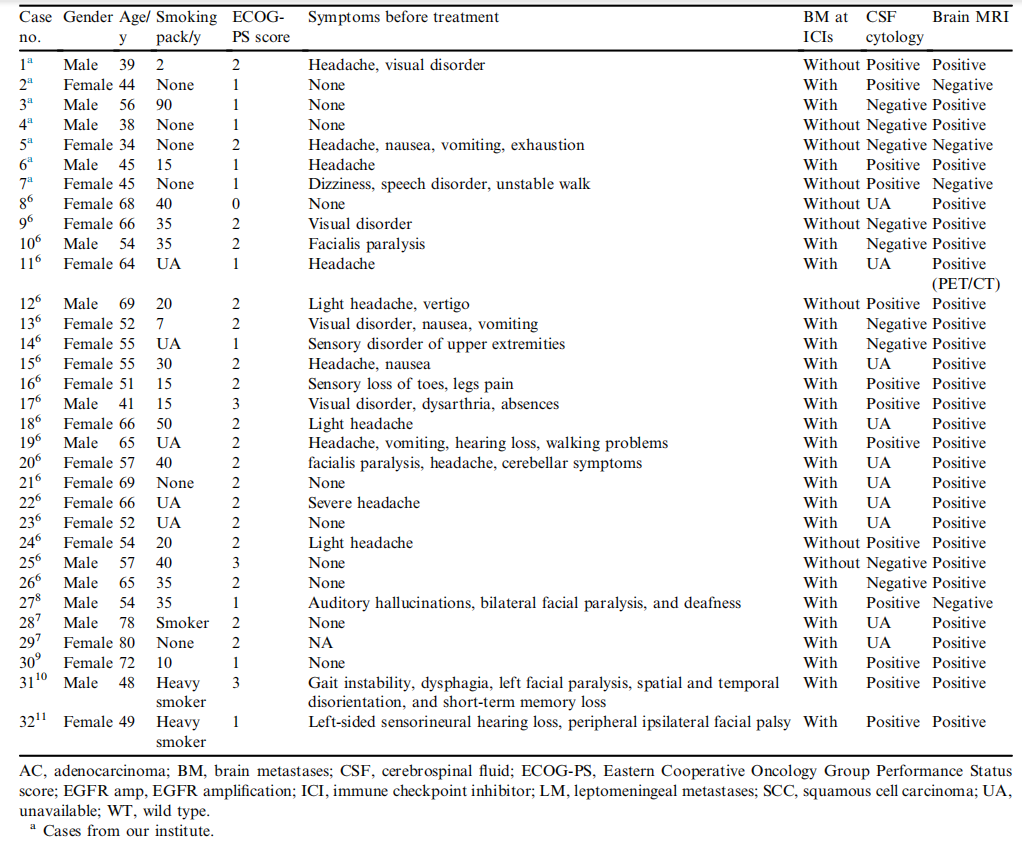
表1 软脑膜转移患者的临床和病理特征
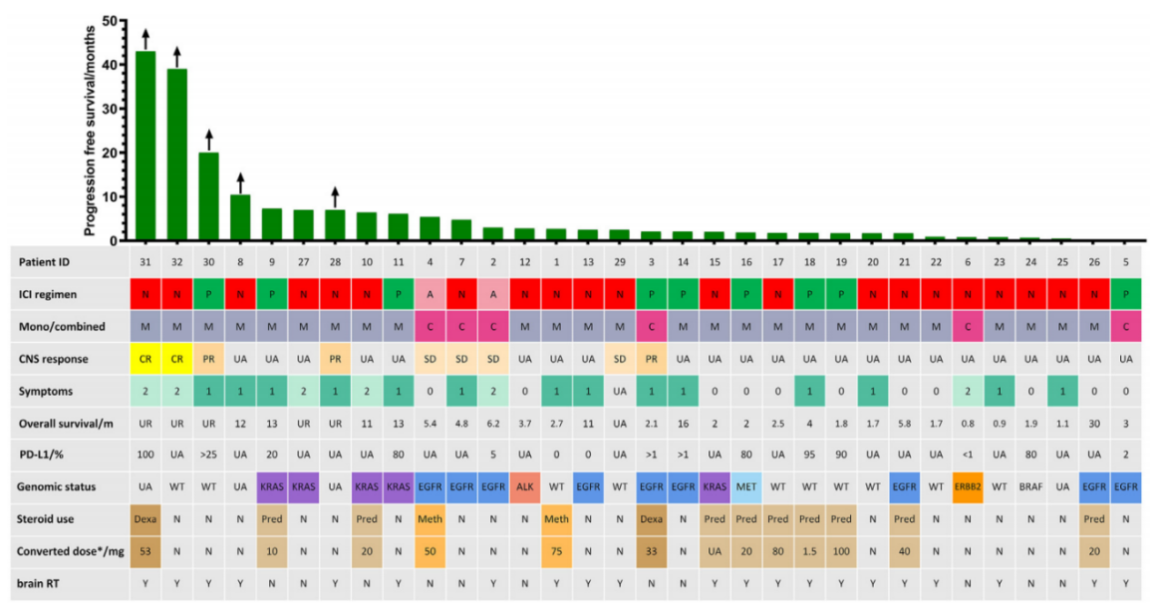
图1 患者治疗史及免疫治疗疗效 注:PFS数据中标注箭头的患者免疫治疗未发生进展;ICI:免疫检查点抑制剂;N:纳武单抗;A:阿特珠单抗;P:派姆单抗;UA:无相关数据;CNS:中枢神经系统;symptoms:0表示恶化;1表示稳定;2表示改善;UR:未达到;WT:野生型;Dex:地塞米松;Pred:泼尼松龙;Met:甲基强的松龙;RT:放疗;Y:是;N:否;患者26检测到EGFR扩增
患者治疗史及免疫治疗方式
13例患者之前服用过类固醇,其中9例使用泼尼松龙,2例使用甲基强的松龙,2例使用地塞米松。所有剂量都转换成泼尼松龙同等剂量,每天1.5至100毫克。其中19例在ICIs之前曾接受过脑放射治疗。纳入的LM患者均未接受ICIs一线治疗,半数患者接受ICIs二线治疗。最常用的免疫药物是纳武单抗,19例患者使用单药,1例接受纳武单抗联合贝伐珠单抗,1例接受纳武单抗联合化疗和贝伐珠单抗。7例患者接受派姆单抗单药,2例患者接受派姆单抗联合化疗。2例患者接受阿特珠单抗联合化疗和贝伐珠单抗。总体来说,6例患者接受免疫联合治疗,26例患者接受免疫单药。诊断LM到开始免疫治疗的中位时间为2.5个月(0.2-21.9个月,图1)。 免疫治疗疗效分析
使用ICIs后,6例患者(18.8%)症状得到改善,14例患者(43.8%)病情稳定,而11例患者病情恶化(34.4%)。在肿瘤反应方面,2例患者(#31和32)同时表现出颅内和颅外完全缓解(CR)。1例患者(#3)表现出颅内和颅外部分缓解(PR),1例患者(#28)表现出颅内和全身部分缓解(PR)。1例患者(#30)出现中枢神经系统部分缓解(PR),但无颅外响应。这5例患者中有3例无驱动基因突变,其中2例PD-L1表达水平超过25%,80%患者在ICI前接受过颅脑放疗,并将免疫治疗作为二线治疗。4例患者表现为中枢神经系统疾病稳定(SD),3例(#2,4,7)颅外SD,1例(#29)颅外疾病进展。
免疫单药组颅内达到CR 2例,PR 2例,SD 1例,中位PFS为2.1个月(95% CI: 1.4-2.9个月),中位OS为4.0个月(95% CI: 0.1-13.3个月)。联合组有1例患者中枢神经系统PR, 3例中枢神经系统SD,中位PFS和OS分别为3.0个月(95% CI: 1.1-4.9个月)和5.4个月(95% CI: 0.5-10.3个月)(图2)。PFS 6个月以上的患者均为EGFR野生型(#8-11, 27-28和30-32)。3例患者PFS超过20个月 (#30-32),其中2例CR,1例PR,2例为EGFR/ALK野生型(图1)。这3例患者在免疫治疗前均接受了头颅放射治疗,使用免疫作为二线治疗。
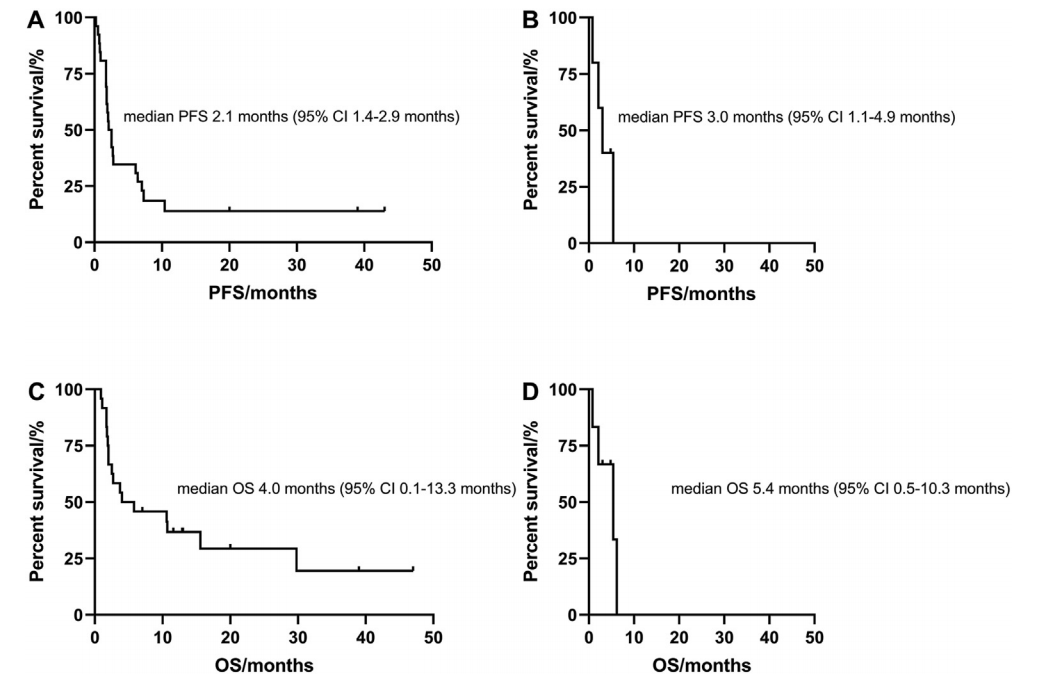
图2 使用免疫检查点抑制剂后的无进展生存期和总生存期 (A,C)ICIs单药治疗PFS和OS; (B,D)ICIs联合治疗PFS和OS 单因素分析显示,ECOG-PS评分(0/1)与PFS延长显著相关(HR=0.45; 95% CI: 0.21-0.97; P=0.04)。此外,ICI治疗后症状改善与PFS延长显著相关 (HR=0.33; 95% CI:0.12-0.91; P=0.002)。单药/联合治疗、性别、吸烟史、PD-L1表达水平、基因组改变、免疫治疗方案(纳武单抗/派姆单抗/阿特珠单抗)和既往脑部放疗或类固醇使用均不影响PFS(图3)。在校正PD-L1表达水平、免疫治疗方案和先前的脑部放射治疗后,多变量分析表明,较好的ECOG-PS评分和PFS延长仍然显著相关(p=0.04)。
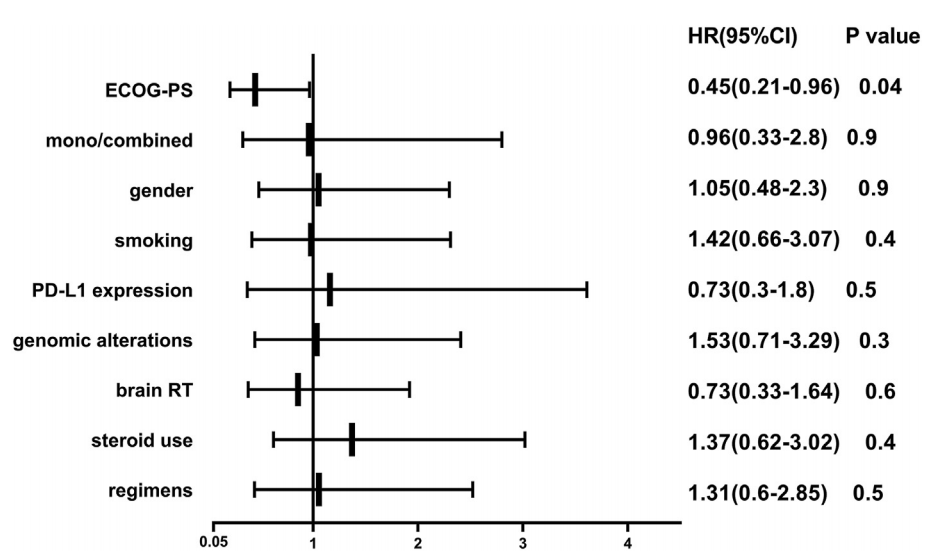
图3 临床因素对PFS的影响
脑脊液ctDNA监测脑膜转移 NSCLC患者对免疫联合化疗的反应
如图4,1例66岁的女性肺腺癌患者携带EGFR L858R突变。接受吉非替尼作为一线治疗,PFS长达17个月,进展后二线和三线治疗分别使用了阿法替尼和奥希替尼,奥希替尼快速进展后使用4周期的培美曲塞联合卡铂和贝伐单抗治疗,而后贝伐单抗维持治疗。随后脑脊液中检出肿瘤细胞,诊断为软脑膜转移。为了降低转移性脑部病变压迫脑干的风险,患者接受了全脑放疗。NGS检测提示患者基线脑脊液和血浆高TMB (16.11muts/Mb和18.25 muts/Mb),随后接受了阿特珠单抗、紫杉醇和安罗替尼的联合方案。治疗两个周期后,第二次腰椎穿刺显示脑脊液肿瘤细胞清除,患者的神经症状也得到改善。根据RECIST评估标准,患者的实质病变获得了PR。脑脊液和血浆ctDNA的动态监测也显示基因突变丰度和TMB显著降低。
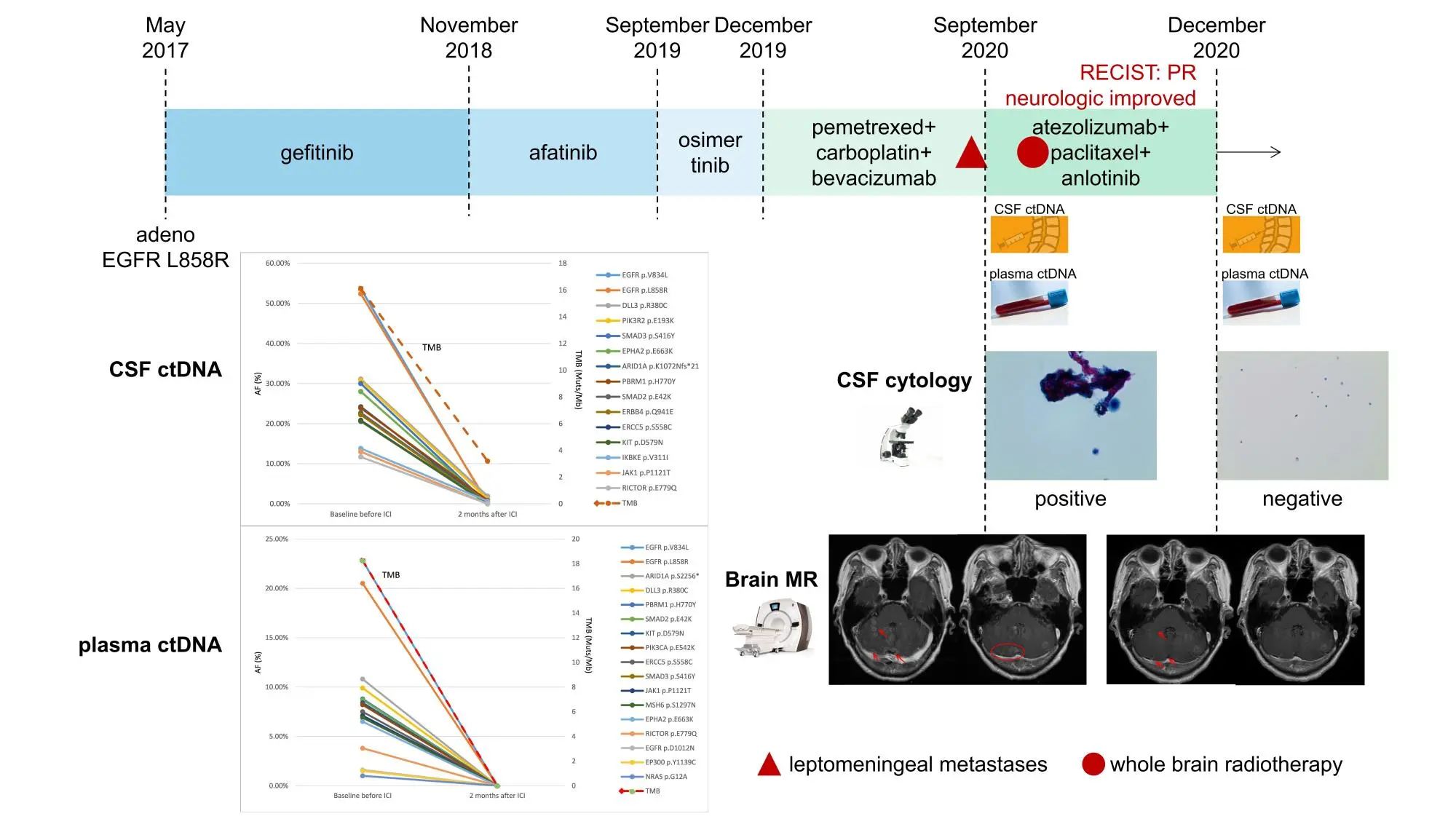
图4 软脑膜转移患者治疗过程及ctDNA动态监测
结论
本研究探究了免疫单药或联合治疗对LM NSCLC患者生存期的影响,表明了LM NSCLC患者可能从免疫单药或联合治疗中获益,尤其是ECOG PS评分较好的患者。同时揭示了脑脊液ctDNA检测可能作为颅内免疫治疗疗效监测方法,为LM NSCLC患者的治疗和疗效监测提供了新的选择。
参考文献
Zheng M M, Tu H Y, Yang J J, et al. Clinical outcomes of non–small cell lung cancer patients with leptomeningeal metastases after immune checkpoint inhibitor treatments[J]. European Journal of Cancer, 2021, 150: 23-30.
| 