杂志:European journal of cardiothoracic surgery发表日期:2025.05.06摘要:⽬的:预测接受新辅助化学免疫治疗的⾮⼩细胞肺癌(NSCLC)患者病理完全缓解(pCR)的可靠⽅法仍在探索中。尽管氟-18 氟脱氧葡萄糖- 正电⼦发射断层扫描/计算机断层扫描(18F-FDG PET/CT)特征反映了肿瘤反应,但它们在预测 pCR ⽅⾯的效⽤仍然存在争议。方法:本回顾性分析纳入了 2019 年 10 月至 2024 年 8 月在上海肺科医院接受新辅助化学免疫治疗后进行 18F-FDG PET/CT 显像的 NSCLC 患者。符合条件的患者以 7:3 的比例随机分为训练队列和验证队列。相关的 18F-FDG PET/CT 特征作为单个预测因子进行评估,并纳入 5 个机器学习(ML)模型。使用受试者工作特征曲线下面积(AUC)评估模型性能,并应用 Shapley 加法解释进行模型解释。结果:共纳入 205 例患者,其中 91 例(44.4%)达到 pCR。治疗后肿瘤最大标准化摄取值(SUVmax)在个体预测因子中表现出最高的预测性能,AUC 为 0.72 (95% CI 0.65-0.79),而ΔT SUVmax 的 AUC 为 0.65 (95% CI 0.53-0.77)。Light Gradient Boosting Machine 算法优于其他模型和单个预测因子,在训练队列中实现了 0.87 (95% CI 0.78-0.97)的平均 AUC,在验证队列中实现了 0.83 (95% CI 0.72-0.94)。Shapley 加法解释分析确定治疗后肿瘤 SUVmax 和治疗后淋巴结体积是关键因素。结论:该 ML 模型为预测 NSCLC 新辅助化学免疫治疗后的 pCR 提供了一种无创且有效的方法。
引言: 18F-FDG PET/CT 结合了 PET 和 CT,可提供对肿瘤位置、大小、结构和代谢活动的详细见解。先前的研究表明,它在预测新辅助免疫治疗后 NSCLC 的病理缓解方面具有实用性。例如,一项研究报告称,肿瘤代谢活性的变化可预测接受纳武利尤单抗治疗的 NSCLC 患者的治疗效果和生存率。同样,另一项研究发现代谢性肿瘤体积是接受 帕博利珠单抗治疗的晚期 NSCLC 患者的预后生物标志物。这些发现强调了 18 F-FDG PET/CT 衍生参数在评估治疗结果中的预测价值,特别是对于原发性肿瘤特征。 ML 已成为分析复杂、高维数据的强大方法,能够在癌症研究中捕获非线性关系。在这项研究中,我们旨在利用来自原发性肿瘤和转移性淋巴结的 18 F-FDG PET/CT 特征来开发用于预测 pCR 的 ML 模型。我们的目标是确定可能从新辅助化学免疫治疗中受益的 NSCLC 患者,并在未来促进个性化治疗。 方法: 研究设计和患者
18F-FDG PET/CT 成像使用双探针、多层扫描仪(GE Millennium VG with Hawkeye)进行。患者接受基于体重的 185-370 MBq 18F-FDG 静脉注射,然后在注射后 60 分钟进行扫描。所有患者在影像学检查前 12 小时禁食,空腹血糖水平维持在 7 mmol/l 以下。全身 PET 扫描由 2 名经验丰富的核医学医师独立评估。 18F-FDG PET/CT 特征包括治疗后肿瘤体积、长度和 SUVmax 以及相应的淋巴结参数。使用公式计算肿瘤和淋巴结体积,体积 = 长度 × 长度 × 宽度。对于治疗前和治疗后均接受 18F-FDG PET/CT 扫描的患者,衍生出捕获代谢和尺寸变化的其他特征,包括 ΔT SUVmax、ΔN SUVmax、ΔT 体积、ΔN 体积、ΔT 长度和 ΔN 长度。这些指标计算为治疗前和治疗后值之间的差异(例如 ΔT SUVmax = 治疗前 T SUVmax - 治疗后 T SUVmax)。pCR 定义为组织病理学评估中所有原发性和淋巴结标本中均不存在活肿瘤细胞。 统计分析
总体而言,根据先前的研究和本研究的目标,选择了 24 个包含患者人口统计学、临床参数和 18F-FDG PET/CT 特征的特征(补充材料,表 S1)。然后使用随机森林算法评估特征重要性,并选择 12 个最重要的特征包含在最终的 ML 模型中(补充材料,图 S1)。 使用受试者工作特征曲线下面积(AUC)、精度、召回率、F1 评分和准确性评估模型性能。DeLong 检验用于比较不同模型的预测性能。采用 Harrell 一致性指数(C-index)评估模型判别能力。此外,还采用校准曲线和决策曲线分析来评估预测概率和实际结果之间的一致性,并分别量化临床效用。机器学习模型的参数在补充材料中介绍。应用 Shapley 加法解释(SHAP)值来解释模型中的特征重要性。统计学显着性设置为 P < 0.05 (2 侧)。 结果
患者特征
使用 AUC 评估新辅助化学免疫治疗后 pCR 个体特征的预测性能。治疗后 T SUVmax 表现出最强的预测性能(AUC 0.72;95% CI 0.65-0.79)(图2A)。治疗后肿瘤特征显示出中等预测疗效,AUC 范围为 0.67 至 0.72。同样,大约 18 个 F-FDG PET/CT 变化特征,例如 ΔT SUVmax,实现了中等性能(AUC 0.65;95% CI 0.53-0.77)(图 2C)。相比之下,治疗后 N 特征作为单个预测因子的预测性能较差,AUC 范围为 0.52 至 0.57(图 2B)。总体而言,所有特征的 AUC 范围为 0.51 至 0.72,凸显了预测能力有限,需要更强大的预测工具。
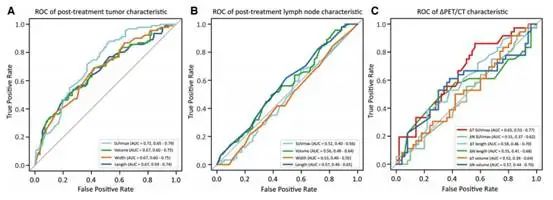
图 2:18F-FDG PET/CT 特征作为 pCR 的单个预测因子的预测性能。(A)治疗后肿瘤特征的 ROC 曲线,(B)治疗后淋巴结特征和(C)用于预测 pCR 的 18F-FDG PET/CT 变化特征。
机器学习模型性能
Supplementary Figure 3 Supplementary Figure 3. The calibration curves of Decision Tree, Random Forest, Logistic Regression and Naïve Bayes for predicting pCR. (pCR, pathological complete response.)
采用 SHAP 分析评估所选变量对接受新辅助化学免疫治疗的 NSCLC 患者 pCR 预测的影响。LightGBM 模型确定治疗后 T SUVmax 和 N 体积是 pCR 预测的关键贡献者(图 4). 这些特征中的值降低与实现 pCR 的可能性更高相关。此外,残留肿瘤比例与治疗后 T SUVmax (r = 0.474, P < 0.001)和治疗后 N 体积(r = 0.224, P = 0.001)的相关性相对较弱,进一步支持了它们的预测相关性(补充材料,图 S4)。
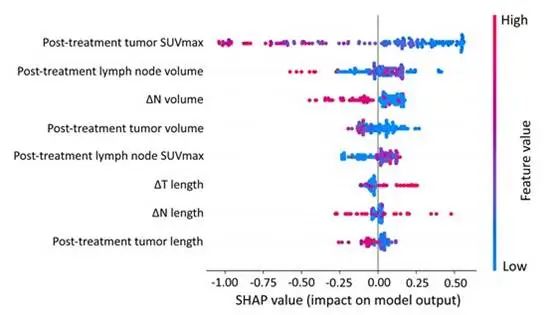
图 4:LightGBM 模型的 Shapley 值分析图。每个特征的分布都详细说明了 Shapley 值。
Supplementary Figure 4.
(A) The percent of residual tumor was positively correlated with post-treatment tumor SUVmax (r = 0.474, p < 0.001). 18F-FDG PET/CT 特征与残留肿瘤百分比的相关性。 决策曲线表明,LightGBM 为 0.00 至 0.98 范围内的决策提供了重要的临床效用,特别是在 0.43 至 0.98 的阈值概率范围内(图 5). 其他 4 个模型的决策曲线显示在补充材料中,图 S5。
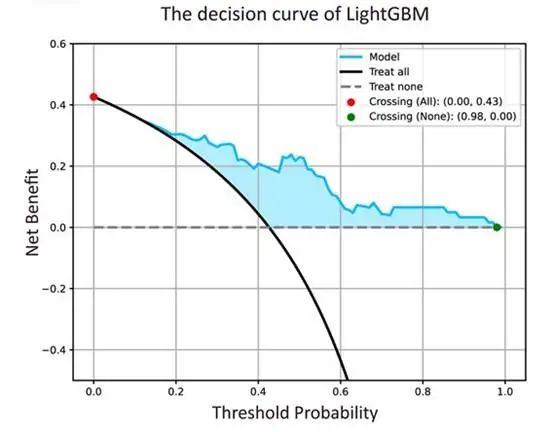
图 5:LightGBM 预测 pCR 的决策曲线。决策曲线显示阈值概率在 0% 到 98% 之间。
The decision curves show that the threshold probabilities for the models are as follows: Decision Tree (37% - 55%), Random Forest (33% - 83%), Logistic Regression (0% - 43%), and Naïve Bayes (23% - 53%). (pCR, pathological complete response.) 决策曲线显示模型的阈值概率如下:决策树(37% - 55%)、随机森林(33% - 83%)、逻辑回归(0% - 43%)和朴素贝叶斯(23% - 53%)。
讨论
新辅助化学免疫疗法已被证明有缩小肿瘤大小的潜力,增加手术切除的可行性,同时解决远处微转移以降低复发率。在临床实践中,我们观察到对新辅助治疗的异质性反应。虽然一小部分患者在 2 个周期后达到临床显著反应,但另一组患者即使在 4 个周期后也表现出次优结果,尽管 NCCN(美国国家综合癌症网络)指南推荐了 3 或 4 个周期的新辅助化学免疫治疗。使用 18F-FDG PET/CT 评估 pCR 有助于识别可能从调整后的治疗计划中受益的患者,从而在未来实现更加个性化的方法。进一步的研究可以探索使用 18F-FDG PET/CT 数据指导治疗持续时间的机器学习模型的潜力。在 NSCLC 新辅助免疫治疗的背景下,先前的研究已经证明了 18F-FDG PET/CT 的代谢信息对 MPR8 的预测价值。Warburg 效应是癌症的标志,反映了肿瘤细胞葡萄糖摄取和糖酵解活性升高。18F-FDG 是一种抗糖酵解的葡萄糖类似物,在肿瘤中积累,广泛用于评估肿瘤代谢活动。肿瘤通常表现出高基线 FDG 摄取,随着肿瘤细胞被根除,在有效的新辅助治疗后,这种摄取会减少。这为观察到的治疗后 T SUVmax 与残余肿瘤负荷之间的相关性及其对治疗反应的强大预测能力提供了生物学依据。例如,我们中心之前的研究报告称,新辅助化学免疫治疗后残留肿瘤 SUVmax 可以预测 MPR,并且在较小程度上可以预测 pCR (AUC 0.74)。这一发现与我们的单个预测变量的结果一致,而我们的 ML 模型实现了更高的 AUC,进一步提高了预测准确性。 Neostar 研究强调,新辅助免疫治疗后,由于非肿瘤免疫细胞浸润,淋巴结中 FDG 的摄取会增加。PD-(L)1 抑制剂激活免疫系统,恢复其抗肿瘤功能,并显着增强免疫细胞(如 CD45+ 淋巴细胞、巨噬细胞和淋巴结树突状细胞)的浸润。尽管我们的研究没有对这些患者淋巴结内免疫细胞浸润进行组织学分析,但在淋巴结中观察到的 FDG 摄取升高可能归因于浸润炎症细胞的糖酵解活性,而不是残留的肿瘤负荷。将免疫介导的 SUV 升高误解为淋巴结转移可能导致术前分期错误,可能将患者排除在根治性手术之外并改变辅助治疗决策。因此,建立适当的 SUV 阈值以区分癌症受累和免疫细胞相关摄取对于提高诊断准确性和为临床决策提供信息至关重要。 这项研究有几个局限性。首先,LightGBM 的灵敏度相对较低,因此不太适合作为独立的筛查工具。在未来的研究中,结合额外的辅助和实验室测试结果可能会优化模型的预测性能。其次,我们队列的 pCR 率为 44.4%,略高于先前报道的接受新辅助化学免疫治疗的 NSCLC 患者的发生率。这种差异可能反映了选择偏倚,因为预后因素更有利且手术资格更高的患者更有可能接受 18F-FDG PET/CT 进行术前综合评估。第三,作为在单个中心进行的回顾性分析,该研究受到选择偏倚的影响,并且缺乏外部队列验证。多中心研究对于确认 ML 模型的普遍性是必要的。第四,尽管我们的 ML 模型为预测 NSCLC 患者新辅助化学免疫治疗后的 pCR 提供了一种有效的方法,但我们不提倡在 NSCLC 中使用观察和等待策略。这主要是由于与预测 pCR 的准确性相关的挑战以及区分阴性 N2 疾病和免疫受影响淋巴结的困难。 结论
翻译及校对:徐彬鑫 |