|
|
作者:全球肿瘤医讯


CAR-T细胞疗法的出现,彻底改变了白血病和淋巴瘤等血液恶性肿瘤的治疗方法,但由于实体瘤免疫抑制性微环境、肿瘤靶点等限制,尽管CAR-T疗法已历经四代的更迭,但目前获批的产品无一例外都是针对血液肿瘤,其在治疗实体瘤领域的应用依然受限。
好消息是,近日《自然进展(Science Advances)》杂志,报道了由美国国家癌症研究所指定的蒙特菲奥里爱因斯坦综合癌症中心(MECCC)历经7年时间,研发出的一款名为“TOP CAR”的新型CAR-T细胞,Zang博士团队对CAR结构的两个关键组成部分进行改造后,不仅提高了CAR-T的持久性,而且显著增加了其攻击癌细胞、增强免疫系统识别的能力。临床前研究已显示出,这款新型CAR-T细胞具有显著缩小肿瘤、提高患者生存率的潜力,可用于治疗肺癌、胰腺癌、胶质母细胞瘤等多款实体瘤。
Zang博士也表示“经过多年的理论研究与技术创新,在未来5年内,CAR-T疗法将在实体瘤治疗领域,迎来重大突破”!让我们拭目以待!

▲截图源自“Sci Adv”
加上两个“外挂”的TOP CAR,显著提高生存率
“TOP CAR”即“TMIGD2优化的强效/持久性(TOP)CAR”,这款新型CAR-T产品主要有两种改变,其一是靶向B7-H3抗原,其二以TMIGD2为协同刺激因子。研究显示,此类在研的新型CAR-T产品,在体外和体内均可有效对抗多种实体瘤。
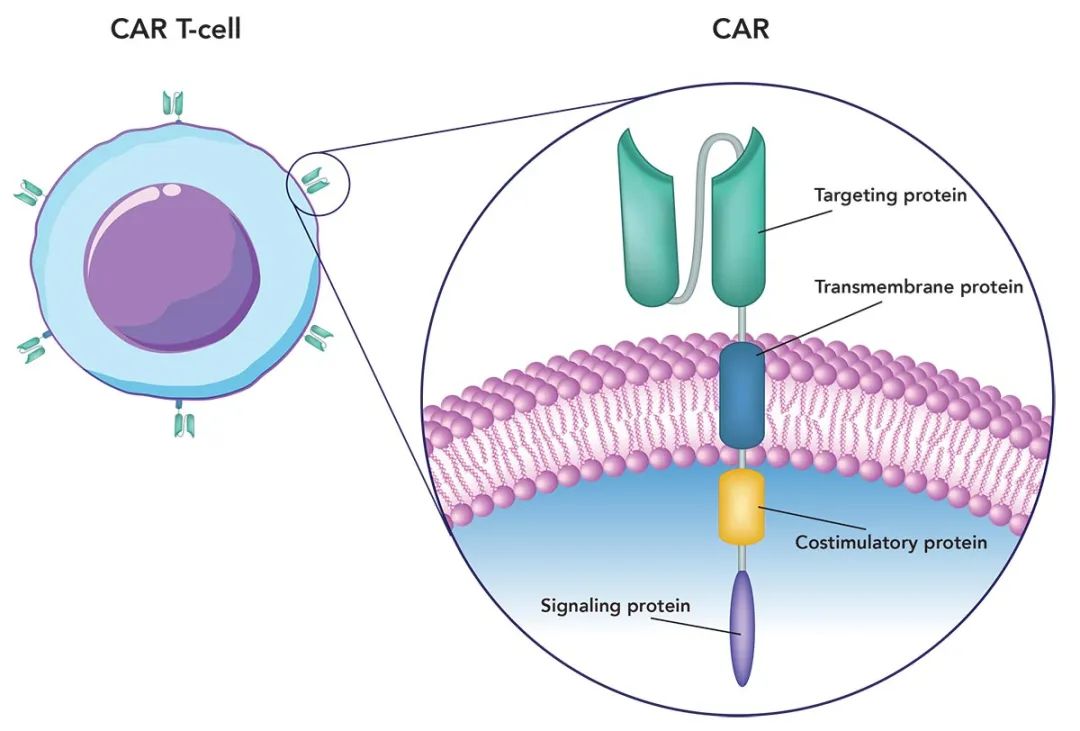
▲图源“EINSTEIN”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①左图:插入合成基因,使T细胞在其表面表达嵌合抗原受体(CAR)。
②右图:显示构成CAR的四种基本蛋白:跨膜蛋白(将CAR锚定到T细胞)、靶向蛋白(识别并结合癌细胞表面的抗原)、共刺激蛋白(与信号蛋白一起激活CAR-T细胞,以摧毁目标癌细胞)。
.
与B7-H3结合的单克隆抗体
“TOP CAR”产品的CAR结构中,应用了一种新型靶向蛋白,即与B7-H3结合的单克隆抗体,作为“导航”的抗原结合域。
B7-H3在大多数实体瘤及肿瘤血管中广泛表达,但在健康组织中表达有限,可作为癌细胞抗原的一种。以B7-H3为靶向的CAR-T细胞,不仅可使T细胞附着在实体瘤上,还可协助T细胞避免癌细胞的干扰。
图1 不同结构设计(B7-H3、CD19 CAR)的CAR-T细胞示例图
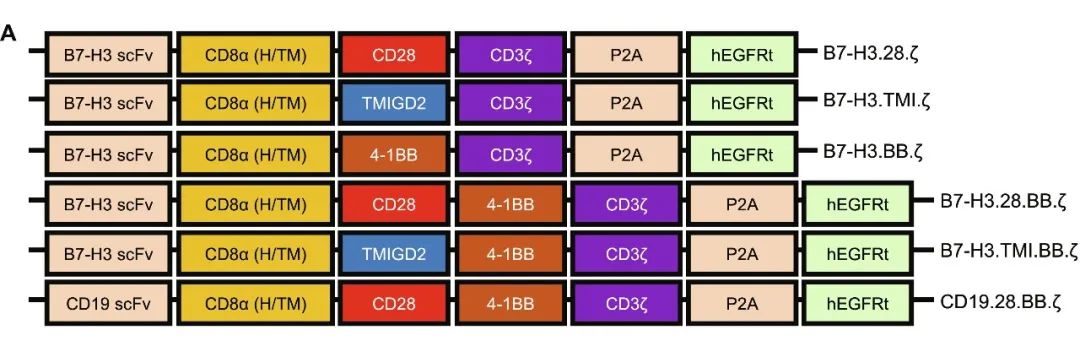
▲图源“ScienceAdvances”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
协同刺激受体:TMIGD2
TMIGD2主要在NK细胞、T细胞上表达,且可在这两类细胞中,诱导独特的协同刺激信号通路,故可帮助CAR-T细胞顺利达到癌细胞,并在实体瘤中持续存在。与第二代(使用CD28或4-1BB)、第三代CAR-T疗法(同时使用CD28及4-1BB)相比,TOP CAR具有如下优势:
1、肿瘤杀伤力更强:肿瘤内CD8/CD4 CAR-T细胞的比例增加,同时保留了线粒体代谢程序完整性。因此,TOP CAR具有肿瘤杀伤能力更强的优势。
2、功能和持久性更佳:中央记忆细胞比例增加,故而,TOP CAR的功能及持久性更佳。
3、副作用更少:降低了细胞因子的产生、耗竭细胞的比例。因此,细胞因子等相关副作用的发生风险也随之降低。
临床前研究显示,与对照CD19.28.BB.z CAR-T 细胞相比,B7-H3 CAR-T 细胞减轻了肿瘤负荷,并提高了总体生存率(详见下图)。
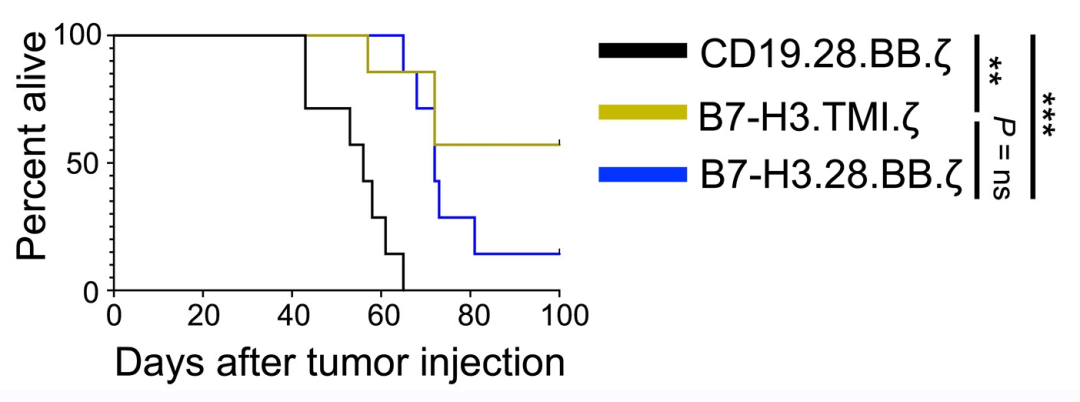
▲图源“ScienceAdvances”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:虽然与CD19 CAR-T细胞相比,两种B7-H3 CAR-T细胞都提高了总体生存率,但与B7-H3.28.BB相比,B7-H3.TMI.ze CAR-T细胞的生存结果更佳。
当然,除了这款“TOP CAR”新型CAR-T细胞疗法外,还有多款CAR-T产品,剑指肺癌、胰腺癌、脑瘤等多款实体瘤,下面全球肿瘤医学部小编简单盘点一下,以供大家参考。
CAR-T助力肺癌“逆风翻盘”:转移灶明显消退
肺癌是呼吸系统恶性肿瘤之一,恶性程度高,预后较差。目前,肺癌的主要治疗手段仍然是手术切除+辅助治疗,但超90%的肺癌患者确诊时已处于晚期,常常错过最佳治疗时机,仅有20%的患者适合手术,5年生存率仅为10%~20%左右。因此,迫切需要寻求新的治疗方法,以阻止肿瘤进展,并延长肺癌患者的生存时间。
而CAR-T细胞疗法被认为是治疗肺癌的一种新策略,该方法首先需从患者的血液中分离 T 细胞,并对T细胞进行基因改造,以识别肿瘤细胞上的抗原,并杀死癌细胞。CAR-T疗法治疗小细胞肺癌(SCLC)、非小细胞肺癌(NSCLC)的潜在靶向抗原详见下图。
图2 CAR-T治疗肺癌的潜在靶向抗原
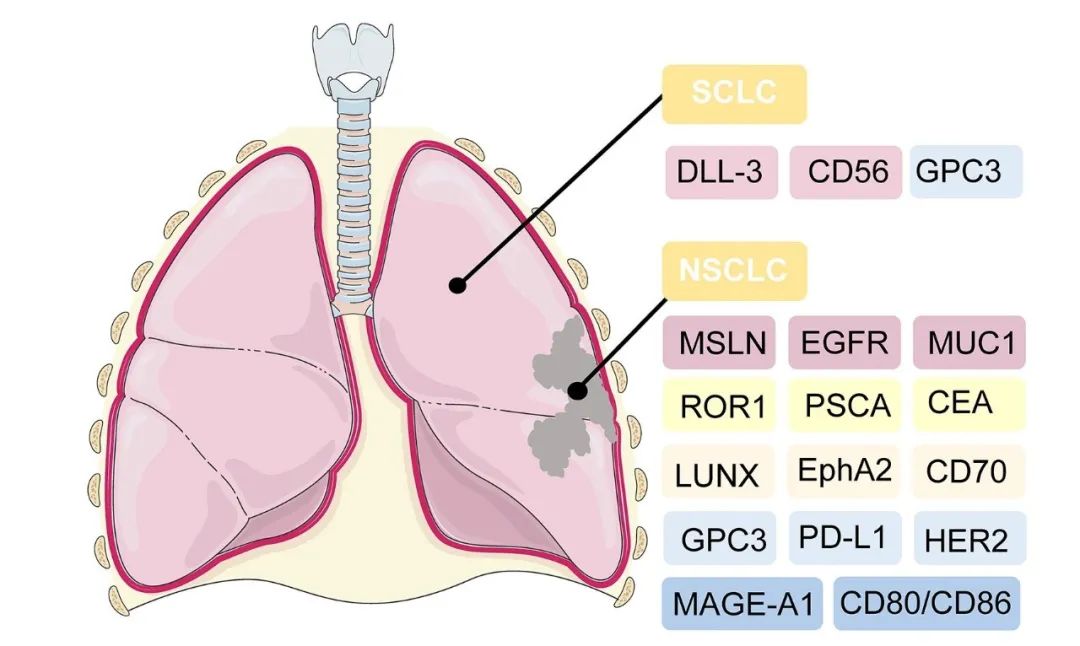
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
知名癌症杂志《癌症分子发病机制调控进展》,在2023年报道过一个“CAR-T细胞治疗非小细胞肺癌(NSCLC)”的案例。该患者为一位68岁男性,经CAR-T细胞治疗后,FDG PET/CT最大强度投影和融合FDG右胸膜转移的轴向图像显示,FDG转移性疾病减少,与治疗效果一致(详见下图)。
图3 该患者CAR-T治疗前后PET/CT对比
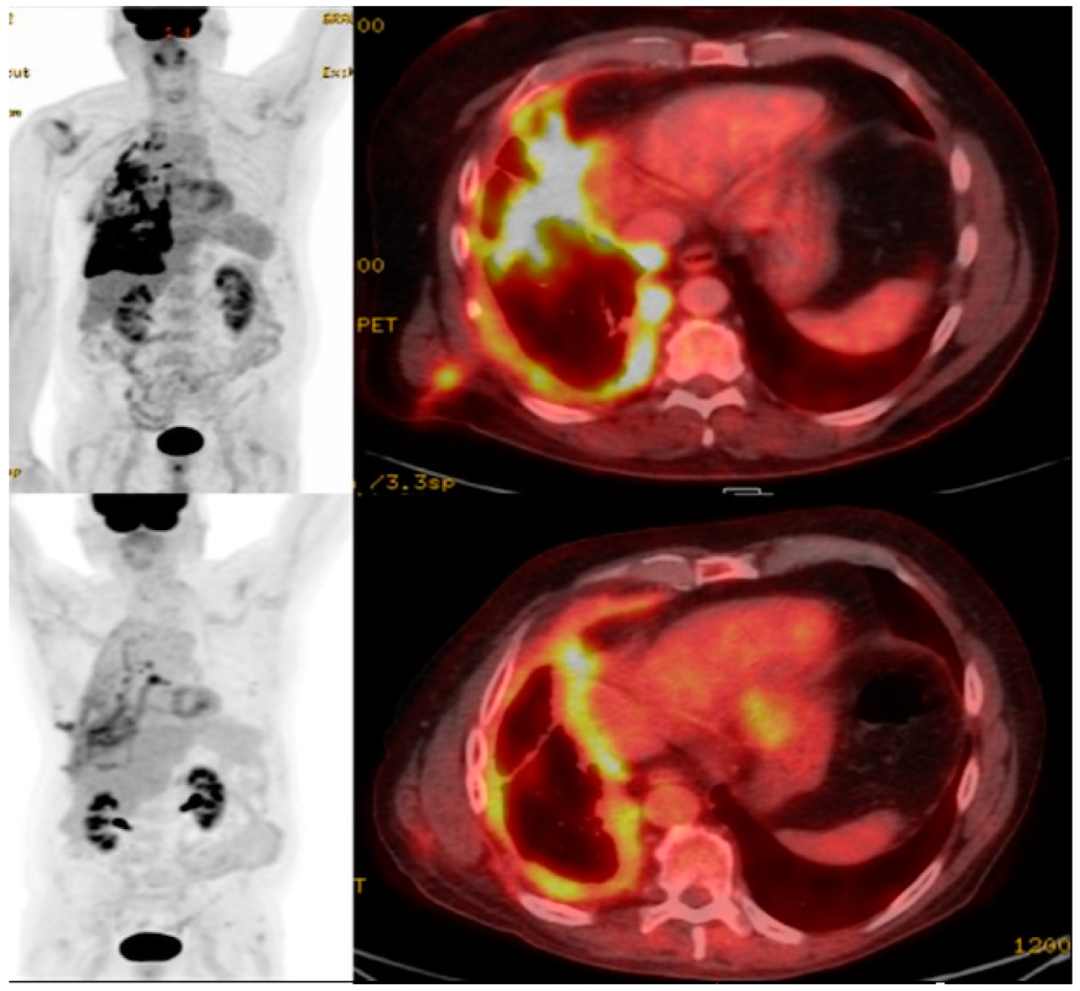
▲图源“MDPI”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CAR-疗法免费申请机会:
好消息是,目前十大CAR-T疗法已启动临床招募,主要针对胃癌、胰腺癌、肠癌、脑胶质瘤、淋巴瘤、骨髓瘤、白血病等多款癌种。感兴趣的病友可阅读原文了解详情:百万疗法免费申请机会来啦!十大CAR-T疗法启动招募,惠及胃癌,肠癌,淋巴瘤等
想寻求CAR-T或其他抗癌新技术帮助的病友,也可将治疗经历、病理检查结果、近期检查报告(如影像学检查、血液检查等)、基因检测报告等资料,提交至全球肿瘤医生网医学部(400-666-7998),初步评估能否有机会接受CAR-T疗法的帮助。
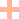
国研CT041 CAR-T单挑胰腺癌,肿瘤缩小超30%《血液学与肿瘤学杂志》报道过一位58岁转移性胰腺癌患者,经CT041(我国自主研制的一款CAR-T产品)治疗后,肿瘤病灶显著缩小的案例。
该患者既往经多种标准治疗效果不佳,肿瘤持续进展,且已发生全身转移,此时临床已无适合她的其他疗法。抱着最后一丝希望,她入组了CT041细胞的临床试验。CT041是我国自主研发的一款针对Claudin18.2(CLDN18.2)的新型CAR-T细胞产品,该靶点在胰腺癌中高表达。
令所有人惊喜的是,该例患者在CT041治疗后,奇迹般地获得了部分缓解(PR),靶病灶显著缩小超过30%,且肺转移灶也表现出了大幅缩小(详见下图)!
图4 该患者CT041治疗前后,肺部影像学对比
▲图源“Penn Medicine News”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:“★”表示“原发病变”
双靶点CAR-T暴击胶质母细胞瘤,治疗2天内肿瘤奇迹缩小
2024年伊始,一款双靶点CAR-T细胞(即CART-EGFR-IL13Rα2细胞),在胶质母细胞瘤(GBM)治疗领域,展现出初步活性和安全性。患者在治疗2天内,就奇迹般地出现了肿瘤缩小表现。这款双靶点CAR-T细胞,打破了传统CAR-T疗法单一靶点的局限,同时靶向IL13Rα2(在75%的胶质母细胞瘤中存在)、EGFR(在60%的胶质母细胞瘤中存在)。
该款CAR-T疗法的1期试验(NCT05168423),共入组6例复发性胶质母细胞瘤患者,经CART-EGFR-IL13Rα2细胞治疗后,复查MRI显示,所有6例患者在治疗1~2天内,肿瘤体积均出现缩小表现(详见下图),且部分患者疗效维持数月。除此之外,CAR-T治疗后的神经毒性也在可控范围内。
总之,上述数据显示,CART-EGFR-IL13Rα2细胞在治疗复发性胶质母细胞瘤领域,具有初步的生物活性及安全性。
图5 一例胶质母细胞瘤患者,双靶点CAR-T治疗前后MRI变化
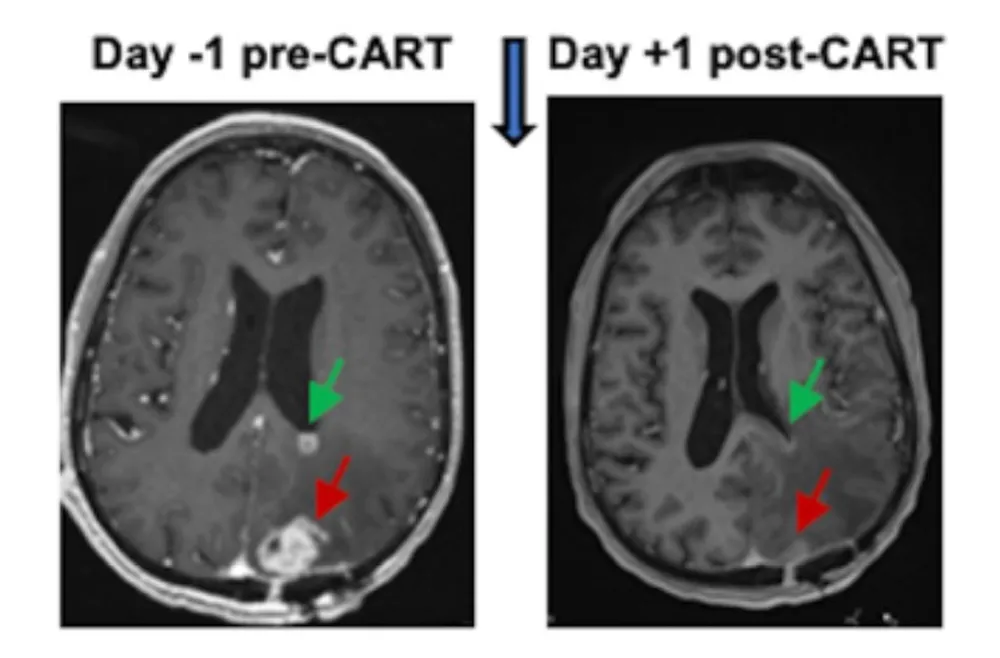
▲图源“Penn Medicine News”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
近一年多以来,CAR-T在实体瘤治疗领域“捷报”频传,除了开篇提到的这款显著缩小肿瘤、提高生存率的靶向B7-H3抗原的TOP CAR细胞外,还出现了针对脑胶质瘤的“双靶点CAR-T”、针对胰腺癌的国研CT041 CAR-T,同时,CAR-T细胞在治疗肺癌、结直肠癌、消化道上皮肿瘤、卵巢癌等其他实体瘤领域,也展现出了不俗的成绩,多款临床试验相继展开,而且已有幸运患者获得完全缓解(CR)!
对现有的治疗方案不满意,或想寻求CAR-T、CAR-NK、TILs、TCR-T等国内外新型抗癌疗法帮助的患者,可以联系全球肿瘤医生网医学部(400-666-7998),进行病情的详细评估或申请国内外抗癌专家的会诊。
参考资料
[1]Nishimura CD,et al.TOP CAR with TMIGD2 as a safe and effective costimulatory domain in CAR cells treating human solid tumors. Sci Adv. 2024 May 10;10(19):eadk1857.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11078193/
[2]Xiao B F,et al.Chimeric antigen receptor T-cell therapy in lung cancer: potential and challenges[J]. Frontiers in Immunology, 2021, 12: 782775.
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.782775/full
[3]Ma H Y,et al.Advances in CAR T Cell Therapy for Non-Small Cell Lung Cancer[J]. Current Issues in Molecular Biology, 2023, 45(11): 9019-9038.
https://www.mdpi.com/1467-3045/45/11/566
[4]Bagley SJ,et al.Intrathecal bivalent CAR T cells targeting EGFR and IL13Rα2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 2024 Mar 13.
https://www.nature.com/articles/s41591-024-02893-z
[5]Qi C,et al.CT041 CAR T cell therapy for Claudin18. 2-positive metastatic pancreatic cancer[J]. Journal of Hematology & Oncology, 2023, 16(1): 102.
https://link.springer.com/article/10.1186/s13045-023-01491-9
[6]https://einsteinmed.edu/news/15202/strengthening-car-t-therapy-to-work-against-solid-tumors/
本文为全球肿瘤医生网原创,未经授权严禁转载
扫描添加病友群
抗癌资讯|新技术|新药研发|权威专家
入群免费领取抗癌资料











|
|