|
以下的微信公众号文章并非是对JTO原文的逐字翻译,考虑是翻译后重新总结编写的文章,感谢编译者肖平博士的专业和细心! JTO原文中,两篇文章的写作和排版方式都不太合适快速阅读。经肖平博士编译编排后,内容/观点条理清晰很多,尤其是反对方部分。 在以下的文章中,我对反对方部分进行的重点标识,以突出论点。──杨学宁

01 正方观点

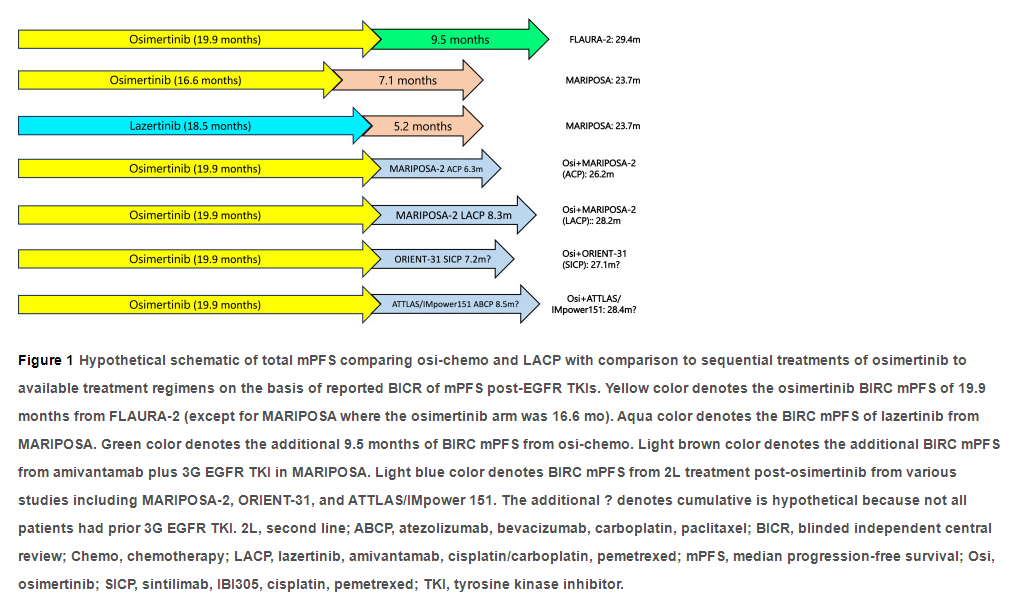
“Don't be afraid to give up the good to go for the great.” ——John D. Rockefeller FLAURA-2达到了其主要终点,即奥希替尼联合铂类培美曲塞化疗(osi-chemo)的中位无进展生存期(mPFS)比单药奥希替尼有统计学改善,风险比(HR)为0.62,osi-chemo改善了8.8个月(研究者评估)和9.5个月(BICR评估)PFS,mPFS达到29.5个月。 重要的是,两个关键的预后因素(外显子19缺失/L858R和脑转移存在与否)在两个研究组之间是平衡的。使用osi-chemo改善9个月的mPFS开创了晚期EGFR+ NSCLC一线(1L)治疗的“第三次工业革命”(mPFS约30 mo)。在此之前,1代 EGFR-TKI成为标准治疗(约10个月mPFS)的“第一次工业革命”和3代 EGFR-TKI(约20个月mPFS)取代1线 1代 EGFR-TKI成为标准治疗的“第二次工业革命”。 目前虽然FLAURA-2缺乏总生存(OS)获益,但这不应阻止临床医师采用osi-chemo,因为所有6个1线 1代 EGFR-TKI与化疗的3期试验(WJTOG3405, NEJ002, EURTAC, OPTIMAL, ENSURE, CONVINCE)均未达到OS获益。同样,具有开创性的AURA-3试验也未达到OS获益。尽管如此,AURA-3的mPFS结果影响了亚洲地区批准4种3代 EGFR TKI(拉泽替尼、阿美替尼、伏美替尼、贝福替尼)用于EGFR T790M+ NSCLC(与AURA-3具有相似的ORR与DOR)。此外,一项类似“FLAURA-2”设计的研究,将阿美替尼联合或不联合化疗作为晚期EGFR+ NSCLC的1线治疗,正在中国进行(NCT04923906),研究以BICR评估的PFS作为主要终点。重要的是要跟进中国国家药品监督管理局是否会基于极有可能的mPFS获益批准阿美替尼联合化疗作为晚期EGFR+ NSCLC的1线治疗。 序贯疗法是osi-chemo的替代方案,但需要达到约9个月的mPFS。目前唯一发表的奥希替尼经治的III期试验是MARIPOSA-2。MARIPOSA-2中包含EGFR-TKI的“四联”方案(lazertinib + amivantamab+含铂双药化疗[LACP])显著改善PFS 8.3个月(化疗组mPFS=4.2个月,HR 0.44)。但是92%接受LACP的患者经历了3级及以上的毒性,77%的患者中断了治疗。22%接受LACP的患者发生静脉血栓栓塞事件,而化疗组患者发生静脉血栓栓塞事件的比例为5%,因此建议在接受LACP的前4个月内进行预防性抗凝治疗。ACP(不含lazertinib)也比化疗组取得了更好的mPFS(6.2个月)(HR=0.48),但6.2个月低于osi-chemo所达到的9个月mPFS获益。不包含EGFR TKI的“四联”方案(化疗+抗血管生成药+免疫检查点抑制剂)被发现比单独化疗组(4.2个月)具有更好的mPFS(ORIENT-31,mPFS为7.2个月,HR=0.51)。IMpower151(EGFR+亚组约占入组患者的52%)和ATTLAS中的atezolizumab加贝伐珠单抗加化疗(ABCP)均达到了8.5个月的mPFS。然而,研究中只有11%(ORIENT-31)、18%(IMpower151)和9%(ATTLAS)纳入了三代EGFR-TKI耐药的患者。此外,在EGFR/ALK亚组中,IMpower151 ABCP的mPFS没有比BCP(mPFS=8.3个月)有统计学改善(HR=0.86)。虽然这些不包含EGFR TKI的方案比较有前途,但研究都是在单一国家进行的,并且纳入的三代EGFR-TKI耐药的患者过少,因此推荐ABCP(或类似的组合)作为奥希替尼耐药后的治疗还为时过早(图1)。图1揭示了序贯治疗可能的“最佳情况”结果,我们认为即使在最佳考虑下,mPFS2也没有达到至少9个月的目标。真实世界中的序贯治疗实际更受限于患者的身体状况。一些研究不允许交叉,患者的后续治疗取决于标准治疗。这种不确定性可能影响到患者的治疗选择和治疗效果,因为并非所有患者都能够根据临床试验的设计获得最佳的、或者是试验中显示有效的后续治疗方案。
抗体-药物偶联物(ADC)也正在3代 EGFR-TKI耐药后开发,但目前报告的疗效至少在三线及以后。在奥希替尼耐药后和化疗后mPFS分别为5.5个月(HERTHENA-Lung-019)到5.8个月(TROPION-Lung-05)。有趣的是,在TROPION-Lung01中,Dato-DXd在一小部分具有可激活基因突变的亚组中HR达到了0.38。在EGFR TKI和化疗经治的患者中,Bl-B01D1(一种双特异性EGFR/HER3 ADC)已达到5.6个月的mPFS。比较HER3-DXd与3代EGFR TKI耐药后采用铂类化疗的试验(HERTHENA-Lung02,NCT05338970)正在进行,结果备受期待。 几乎所有EGFR+ NSCLC患者的主要亚组都从FLAURA-2(外显子19缺失,L858R,基线脑转移)中受益。尽管基线无脑转移患者中,osi-chemo组mPFS绝对增加了6.6个月,但HR为0.75(95% CI:0.55-1.03)。在奥希替尼基础上加用化疗可使颅内反应从71%提高至78%,中枢神经系统进展从23%降低至9%,这可能源于持续性细胞的消除和最大程度的细胞减少。根据方案设计,在FLAURA-2中,基线无脑转移的患者未接受定期的颅脑影像检查。因此,考虑到化疗的颅内外效应,不能排除如果定期进行脑成像,在基线无脑转移的患者中可能获得统计学显著的HR获益(因为无症状的脑转移可能在较早的间隔期被检测到)。相比之下,在MARIPOSA试验(对所有患者进行定期的脑成像)中,有或无脑转移患者的HR相同,均为0.69,在MARIPOSA试验中,基线有脑转移的患者mPFS改善时间为13.0~18.3个月,而在osi-chemo患者中,基线有脑转移的患者mPFS改善时间为13.8~24.9个月(HR=0.47)。 FLAURA-2方案中奥希替尼与培美曲塞维持治疗,直至进展和累积毒性成为患者和临床医师关注的重点。FLAURA-2中化疗的中位周期为16(4 + 12个维持周期),这与其他两个化疗联合1代 EGFR-TKI的3期试验一致:Tata Memorial Centre试验为15个周期(4 + 11)和NEJ 009为20个周期(4 + 16)。现有数据表明,12个月的化疗可能足以实现FLAURA-2中报告的mPFS获益。重要的是,奥希替尼的平均相对剂量强度在联合治疗组为95%,在奥希替尼组为98%,表明同时进行化疗并不影响奥希替尼的累积剂量。而中位PFS是否与化疗时间呈正相关,这是FLAURA-2需要回答的重要问题。 “无化疗”方案是肿瘤内科医生和患者的共同理想目标。MARIPOSA研究显示,lazertinib + amivantamab(LA)的中位PFS改善优于奥希替尼,HR为0.70,BICR评估显示中位PFS绝对增加7.1个月,总中位PFS为23.7个月。简单的交叉试验比较显示,LA的所有三个值(HR、中位PFS绝对增加、总中位PFS)在数值上均低于奥希替尼联合化疗。此外,LA方案导致75%的患者发生≥3级毒性,83%的患者减少剂量,37%的患者发生静脉血栓栓塞事件。虽然在MARIPOSA中amivantamab不是“化疗”,但在前5周内每周静脉注射,然后每2周一次,这个时间成本比osi-chemo对患者和护理人员多50%以上的时间,另外还需要额外的医疗资源来管理皮肤毒性。FLAURA-2和MARIPOSA分别报告了初步PFS2获益(osi-chemo HR = 0.7;95% CI:0.52-0.93和LA HR = 0.75;95% CI:0.58-0.98),表明即使在osi-chemo中一线联合标准化疗,进展后的治疗也是有效的。 化疗联合EGFR TKI的禁忌起源于早期在非选择性NSCLC的大规模试验中缺乏OS改善(INTACT 1, INTACT 2, TRIBUTE, TALENT),并在IMPRESS19中EGFR T790M+ NSCLC联合治疗降低了患者的OS,当时我们对EGFR突变的认识尚不充分。随着吉非替尼联合化疗的阳性OS数据,这种看法开始改变,现在被FLAURA-2改变。FLAURA-2研究中,osi-chemo中获益的确切机制尚不清楚,但研究者认为,化疗通过非选择性抗肿瘤作用并克服肿瘤内异质性,包括那些对奥希替尼不敏感的细胞,从而增强了整体的抗肿瘤效果。此外,虽然未来对预测性生物标志物的研究可能会进一步细化最有可能从osi-chemo获益的患者人群,但目前没有序贯疗法可以可靠地弥补osi-chemo的9个月优势。我们的终极目标是为患者争取时间,而osi-chemo提供了这种下一个治疗阶段的机会。
02 反方观点

EGFR突变占晚期非鳞状NSCLC的15%-50%。奥希替尼是美国食品和药物管理局批准用于EGFR突变晚期NSCLC一线治疗的标准治疗。尽管不断努力,但疾病进展仍然不可避免,尤其是携带L858R的患者脑转移发生率高,预后不良。此前,第一代EGFR TKIs联合化疗,表现出无进展生存期(PFS)的获益,但以毒性为代价,并且总生存期(OS)无获益。FLAURA2研究进行了评估奥希替尼联合铂类化疗的疗效和安全性。尽管奥希替尼联合化疗达到了PFS的主要终点,但这种联合治疗仍有相当大的局限性,如毒性增加、静脉给药的不便,以及是否达到了改善PFS和可接受毒性之间的平衡的最终目标。 本文详细讨论了为什么奥希替尼联合铂类化疗不能成为所有EGFR突变晚期NSCLC患者的新治疗标准。尽管FLAURA2是一项关键研究,尤其对EGFR L858R和脑转移患者,但仍有几个关键问题有待回答。 第一个,也是最重要的问题是,在所有患者中,奥希替尼联合铂类培美曲塞是否比单独使用奥希替尼更有好处。 FLAURA2达到了PFS改善8.8个月的主要终点。其对照组奥希替尼单药治疗的中位PFS为16.7个月,低于FLAURA 3期研究的18.9个月。PFS的亚组分析显示,在种族(亚洲/非亚洲)、EGFR突变亚型(外显子19缺失/L858R)和中枢神经系统(CNS)转移中,疗效一致。然而,奥希替尼联合化疗的PFS2或OS未见获益。两个治疗组的PFS2趋于一致,奥希替尼联合化疗的PFS2仅有3个月的获益。OS的期中分析显示,奥希替尼联合化疗未显示出优于奥希替尼单药治疗的获益(HR 0.90,0.65-1.24,p = 0.5238)。两组的Kaplan-Meier曲线未显示奥希替尼联合化疗的OS获益趋势[N Engl J Med. 2023 Nov 23;389(21):1935-1948.]。因此,添加化疗延长了PFS,但最终可能无法转化为OS获益。 此外,奥希替尼联合化疗组中54%的患者未接受后续化疗,33%的患者再次接受细胞毒性化疗。这些表明,在奥希替尼联合化疗失败后,可能没有有效的后续治疗选择。新型药物如Dato-Dxd,在2期研究TROPION-Lung05,在EGFR突变亚组中,具有可靶向基因组改变的标准治疗后的晚期难治性NSCLC患者中,ORR为43.6%。Patritumab deruxtecan,一种靶向EGFR 3(HER3)的ADC,在2期研究HERTHENA-Lung01中显示出有限的疗效,在既往接受EGFR TKI和铂类化疗的患者中,经证实的客观缓解率为29.8%,中位PFS为5.5个月。因此与其同时进行化疗,为什么不把化疗留到二线及后线的治疗上呢? 第三,奥希替尼联合化疗的毒性特征在临床中是否可控。 在联合治疗组中,只有77%的患者完成了4个铂类培美曲塞周期,导致治疗中断的不良事件在联合治疗组中显著升高(48%vs 6%)。在联合治疗组中,停药的患者中,奥希替尼停药率为11%,是奥希替尼单药治疗停药率(6%)的两倍,此外还有化疗的停药率(铂类17%,培美曲塞43%)。尽管不良事件(AEs)的频率和严重程度在诱导期(0-3个月)最高,并在维持期(9个月后)下降,但应该注意,无论付出什么代价,奥希替尼停药都是不可接受的。使用培美曲塞维持治疗的做法已被认为是安全可行的,但其与奥希替尼联合使用会导致显著的毒性,此外,每三周一次的就诊也会带来不便。 第四,化疗是否是奥希替尼的最佳组合伙伴。 目前的努力主要集中在EGFR TKIs与化疗、靶向药物或抗血管生成药物(包括贝伐珠单抗和雷莫芦单抗)的联合治疗上。然而,关于奥希替尼与抗血管生成药物的联合治疗,结果并不一致。在2期WJOG9717L研究中,奥希替尼联合贝伐珠单抗作为一线治疗未能改善PFS,并等待正在进行的3期研究(NCT0418060)结果。最近,奥希替尼联合雷莫芦单抗的2期RAMOSE试验的中期分析报告了PFS的改善(24.8个月对15.6个月,HR = 0.55,95% CI:0.32-0.93,p = 0.023 )。全球3期研究MARIPOSA(NCT04487080)中,lazertinib + amivantamab联合治疗被证明是治疗初治EGFR突变晚期NSCLC患者的另一种前期联合治疗策略。与奥希替尼单药治疗相比,lazertinib + amivantamab将PFS改善了7.1个月(23.7个月对16.6个月,HR = 0.70,95% CI:0.58-0.85),虽然PFS的数值短于FLAURA2,但交叉试验比较应谨慎解读。在中位随访22个月时,中期OS(25%)表明12个月时Kaplan-Meier曲线早期分离 (HR = 0.75,95% CI:0.58-0.98,p = 0.03)。对于这一发现有两种似乎合理的解释。首先,通过将amivantamab作为一线治疗,可能直接抑制MET相关的耐药机制。其次,为后续治疗保留化疗,如组织学转化为鳞状细胞癌或SCLC。 在我们等待MARIPOSA数据成熟和最终OS数据时,lazertinib + amivantamab的毒性管理是增强抗肿瘤活性,同时保持应答持续时间和深度的关键。联合使用lazertinib + amivantamab会产生抑制EGFR(甲沟炎、皮疹、腹泻)和MET(低白蛋白血症、外周水肿)的AE,以及联合治疗的静脉血栓栓塞,需要在治疗期间进行4个月的预防性抗凝。输液相关反应和其他AE的发生率以及静脉给药的不便可能可以通过皮下给药amivantamab来改善,而不是静脉给药。PALOMA-2(NCT05498428)是一项皮下给药amivantamab用于晚期实体瘤(包括EGFR突变NSCLC)的2期研究。然而,lazertinib + amivantamab的耐受性仍然是一个障碍,药物的中断(83%)、减少(59%)和停药(35%)的发生率都很高,此外还需要频繁的门诊就诊。 第五,对于某些特定的患者亚组(如脑转移患者),是否应该考虑奥希替尼联合化疗仍然存在一定的疑问。 脑转移患者的亚组分析显示CNS PFS改善(HR = 0.47,95% CI:0.33-0.66)。然而,仅基于CNS亚组分析解读并将其应用于实际实践需要谨慎。考虑到奥希替尼的颅内疗效优越,对无症状、寡脑转移患者增加化疗应受到质疑。因此,脑转移的数量和肿瘤负荷也应考虑在内。此外,化疗增强CNS疗效背后的机制应通过前瞻性随机对照试验来支持,以支持化疗对接受奥希替尼治疗的脑转移患者的增效的观点。在此之前,脑转移的立体定向放疗仍然是一个可行的选择。与其给每个人预先化疗,不如在初始TKI治疗后,在循环肿瘤DNA(ctDNA)检测的基础上加强治疗。目前,针对高危患者(包括TP53突变和C2D1时ctDNA阳性)的化疗联合治疗策略正在研究中(表1)。一项基于第2周期第1日采集的可检测ctDNA,对奥希替尼单药或联合化疗进行的2期研究(NCT04410796)可能为特定患者亚组的强化治疗提供答案。

目前奥希替尼单药治疗仍是晚期EGFR突变型NSCLC患者的标准治疗。然而,联合治疗的需求仍未得到满足。尽管联合治疗毒性增加,但该治疗方案不应仅改善PFS,还应有OS获益。在奥希替尼基础上增加铂类化疗可改善PFS,但问题仍然存在:是否每个人都需要前期给予铂类双联治疗?鉴于临床试验之外的奥希替尼耐药患者的治疗选择很少(即培美曲塞-铂类、多西他赛),化疗应留作后续治疗。因此,识别可能从联合治疗中获益的患者亚组,并实施生物标志物(如ctDNA)对于EGFR突变型NSCLC患者采用前期化疗联合治疗至关重要。
1、Chen LN, Lee ATM, Nagasaka M, Ou SI. Chemotherapy and Osimertinib Combination Should Be the First-Line Treatment for All Advanced EGFR+ NSCLC. J Thorac Oncol. 2024 Mar;19(3):380-384. doi: 10.1016/j.jtho.2023.12.018. PMID: 38453326. 2、Lim SM, Lee JB, Cho BC. Chemotherapy and Osimertinib Combination Should Not Be the First-Line Treatment for All Advanced EGFR+ NSCLC. J Thorac Oncol. 2024 Mar;19(3):376-379. doi: 10.1016/j.jtho.2023.12.007. PMID: 38453325. |