|
2021年11月,CDE发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》。此后,“以临床价值为导向”成为了最热门的概念和话题之一,各种视角的解读层出不穷。在医药研发过程中,如何真正体现“临床价值”?靶点、适应症扎堆以“临床价值”为导向了吗?创新疗法就一定代表了“临床价值”吗?
2023 中国国际药物信息大会/DIA 2023中国年会暨展览会期间,中国医学科学院肿瘤医院GCP中心吴大维医生和参会者探讨了这一话题,并列举了4个“不”以临床价值为导向临床研究的特点:· 研究纳入人群偏离了真实的诊疗环境。例如:针对复发/难治性B细胞淋巴瘤,患者纳入标准为年龄小于等于65岁。· 研究的对照组并没有为受试者提供最合理的标准治疗方案。例如:现阶段如果还要开展一项PD-1/PD-L1抑制剂晚期NSCLC一线治疗临床试验,对照组仍为化疗。· 试验组药物已经为某一癌种的晚期二线标准治疗方案,其在进行晚期一线适应症探索的临床试验时,方案规定原则上不允许患者在疾病进展时揭盲获知治疗方案,这是不合理的。· 联合方案的“add-on”策略是否应该成为主流?
没有具体的实例,似乎意犹未尽,于是小编补充了一些实例,希望能帮助大家更好的理解。一、研究人群的选择以弥漫大B细胞淋巴瘤(DLBCL)为例,以下是几个经典临床研究的患者年龄纳入标准:1、MInT研究(R-CHOP vs. CHOP),纳入18~60岁患者。2、LNH98-5研究(R-CHOP vs. CHOP),针对老年人群,纳入60~80岁患者,其中>70岁者占~50%。3、ROBUST研究(来那度胺+R-CHOP vs. 安慰剂+R-CHOP),纳入18~80岁患者,>70岁者占~30%。普遍DLBCL临床研究纳入患者的中位年龄~65岁。 大B细胞淋巴瘤的发病率随着年龄的增长而升高,~40%的病例发生在>70岁患者中。但是,很少有关>80岁患者预后的前瞻性数据。老年大B细胞淋巴瘤是否和较年轻患者有本质区别,目前尚不清楚。老年患者对治疗的应答并不明显低于较年轻者,但治疗耐受性差,出现骨髓抑制等治疗相关并发症的概率增加。因此,是否可以优化治疗方案,提高治疗耐受性的同时保证疗效,是临床医生们关注的问题。 为了解答这个问题,法国成人淋巴瘤协作组(GELA)开展了一项前瞻性、多中心、单臂II期临床研究(NCT01087424),纳入150名患者,中位年龄为83岁(80~95岁)。结果显示,R-miniCHOP方案在年龄>80岁患者中,有效性和安全性得到了很好的平衡,应该视为该亚组人群的标准治疗,这体现了真正的临床价值。 再以大家熟知的免疫治疗为例。2023年1月26日,JAMA Oncology发表了一项针对晚期NSCLC的回顾性、多中心队列研究结果。结果显示,在免疫检查点抑制剂(ICI)获批以前,2011~2015年,各年龄组的中位OS几乎无差异。而在2015-2019年接受治疗的患者(下图),<55岁年龄组的中位OS在2015年和2019年分别为14.8个月和19个月(+4.2个月),≥75岁年龄组的中位OS在2015年和2019年分别为12.3个月和13个月(+0.7个月)。
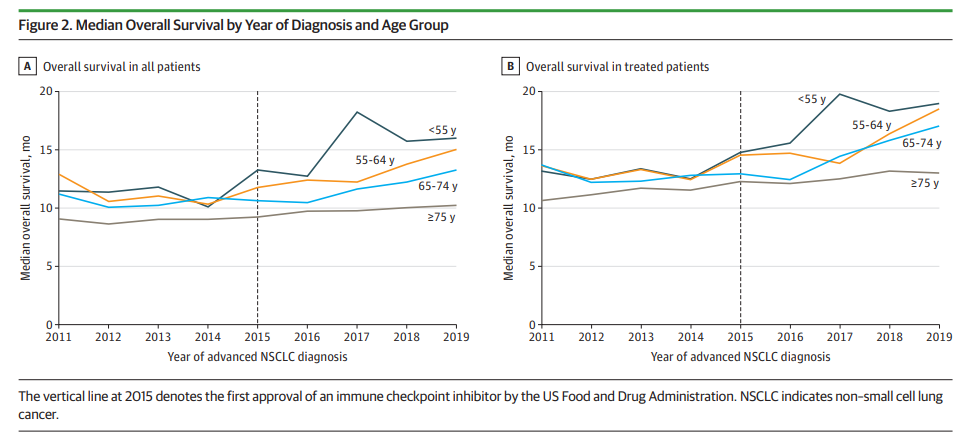
研究者表示,考虑到诊断肺癌时的中位年龄~70岁,且根据ASCO的定义,有临床意义的获益是鳞状和非鳞状NSCLC的OS分别延长超过3.25个月和2.5个月,而在较大年龄组中未观察到有显著临床意义的获益。临床试验受试者通常是最合适的人选,但并不一定代表在临床实践中接受癌症治疗的一般患者人群,这可能会限制在临床实践中解读和广泛应用临床试验得出的生存曲线的能力。 二、对照组的选择 前列腺癌领域的PROfound研究,纳入了存在DNA修复基因突变的转移性去势抵抗性前列腺癌 (mCRPC) 患者,这些患者在接受至少一种雄激素受体靶向药物(ARTA)恩杂鲁胺或阿比特龙后出现疾病进展。试验组患者接受奥拉帕利(PARP抑制剂)治疗,SOC组患者接受医生选择的治疗。 事实上,“医生选择”这个标签具有误导性,因为选择范围只有阿比特龙或恩杂鲁胺,而受试者在进入试验前就已经接受过抗激素治疗了。而且,有~20%的患者既往已接受过阿比特龙和恩杂鲁胺治疗。有35%的患者既往未接受过多西他赛治疗,45%的患者接受过多西他赛但未接受过卡巴他赛治疗———这些均已被证明可提高mCRPC的生存率。 因此,事实上,对照组中有20%的患者接受了具有副作用的“安慰剂”(ARTA进展后继续使用ARTA),80%的患者未接受有效的化疗。该研究结果显示,接受奥拉帕利治疗可以延长患者的OS,如果对照组允许“真正的”医生选择,是否还会是阳性结果?2019年6月,有一项发表在JAMA Oncology的研究,对FDA批准抗肿瘤药物基于的RCT中的对照组质量进行评估。纳入2013年1月1日~2018年7月31日期间共145项研究,排除48项单臂研究,最终共分析了97项研究,与95个药物获批有关。
其中,16个(17%)是基于次优对照组的RCT(见下图,涉及的药品包括:venetoclax,apalutamide,奥拉帕利,bosutinib,维布妥昔单抗,塞瑞替尼,帕博利珠单抗,恩扎卢胺,olaratumab,卡博替尼,依维莫司,奥妥珠单抗,伊沙佐米,雷莫芦单抗,阿法替尼)。
研究者在讨论中表示,一方面,决定SOC具有一定的主观性,次优SOC更容易得到阳性结果,加速产品上市;另一方面,还会受到利益相关者的外部影响,例如:药企的推动,疾病治疗的迫切需求,市场上缺乏有效的药物等。
三、交叉(crossover)问题 随机试验中交叉很常见。“交叉”通常是指进展后的单向交叉,“单向”是指安慰剂组的患者可以使用研究药物,而不是相反(双向)。在一定情况下,交叉被认为是符合伦理或必要的。交叉的局限性在于它可能影响交叉事件后测量的终点。需要注意的是,在肿瘤学领域中,交叉可能是合理的,也可能是不合理的,这需要具体情况具体分析。实际情况中,这两种错误都有:应该允许交叉但没有允许,或者不应该交叉但允许了。 当一种药物在后线治疗中已经被证明能够获益,并且正在尝试将其推进到更早的治疗线时(注:吴医生的第三个举例就属于这种情况),交叉是合理的。以NSCLC的KEYNOTE-024研究为例,PD-L1高表达患者一线接受帕博利珠单抗或化疗。在这项研究之前,PD-1抑制剂已经成为二线标准治疗。因此,在KEYNOTE-024研究中,如果受试者出现疾病进展,允许交叉至使用帕博利珠单抗治疗是合理的。这里略扩展一下,在部分类型的试验中,交叉可能存在问题。一项针对转移性前列腺癌的sipuleucel-T(注:肿瘤疫苗)或安慰剂的随机试验中,患者进展后被允许使用疫苗,尽管这种治疗的疗效尚未确定。这意味着对照组中没有接受多西他赛或延迟接受多西他赛的患者高于积极治疗组。多西他赛已经证实对这种癌症的生存有益。该研究中,缓解率和PFS(终点不受交叉影响)并未因治疗而改善,而OS却有所改善。允许交叉(对照组中72%的患者)导致无法明确延长的生存期是由于治疗真正有效还是由于对照组中后续有效治疗的延迟。 四、联合治疗问题 再次以PD-1/PD-L1抑制剂的免疫联合治疗为例。2022年1月,发表在《临床癌症研究》(CCR)上的一项研究,评估了13项免疫治疗药物的组合,发现联合疗法的益处似乎来自每种药物的独立作用,而非协同增效。研究者纳入分析了13项III期临床试验,这些试验包含晚期黑色素瘤和肺癌、乳腺癌、胃癌、肾癌和头颈癌等。 研究人员根据联合疗法中各单药组分在相同或近似试验队列中的临床疗效,利用独立药物作用模型(a model of independent drug action)计算预期的PFS曲线。评估几种目前批准的抗肿瘤药物组合是否具有独立或叠加/协同的药物作用。
图:在临床试验中观察到的联合疗法 PFS(蓝色线),以及根据联合疗法中各单药组分的疗效预测的PFS(黑线和灰色范围)。联合治疗数据来自 (A)CheckMate067,(B) KEYNOTE-189, (C) KEYNOTE-407 , (D) IMpassion130 , (E) KEYNOTE -426, (F) JAVELIN Renal 101, (G) IMpower133 和 CASPIAN, (H)IMpower130
结果显示,FDA批准的所有13种免疫检查点抑制剂联合用药均符合药物非依赖性零模型(a null model of drug independence),这意味着没有证据表明免疫检查点抑制剂与其他药物具有协同/叠加作用。
这些发现并不意味着评估药物联合疗法的临床试验是错误的,其意义在于促使科学家重新思考“协同作用”理念的真正价值。
当两种具有独立抗肿瘤活性的治疗方法——实际情况下常序贯使用,即在疾病进展后切换到第二种药物——作为联合治疗时,毒性几乎总是有增加的。如果联合两种药物,可能会影响进展后的治疗选择。另有一个非常重要的问题,不是评估A+B比A好或是比B好,而是A+B比A→B好、还是B→A好。此外,患者受到的经济毒性,以及增加的治疗负担,也是需要考虑的因素。研究人员应该加倍努力了解癌症药物背后的基本机制,从而让肿瘤学家有能力为合适的患者量身定制完美的治疗方案。 参考文献 1、JAMA Oncol. 2023. doi:10.1001/jamaoncol.2022.6901 2、JAMA Oncol. 2023. doi:10.1001/jamaoncol.2022.6867 3、Clin Cancer Res. 2022 Jan 15;28(2):368-377. 4、J Clin Oncol. 2022; JCO2102304. Online ahead of print. 5、JAMA Oncol. 2019; 5(6): 887-892. 6、Ann Oncol. 2018; 29(5):1079-1081. doi: 10.1093/annonc/mdy116. |