|
|
作者:CardiothoracicSurgery
*仅供医学专业人士参考

发表杂志
Journal of Thoracic Oncology
影响因子:IF=20.40
发表时间:2023-6-20
摘 要
背景:在确定同步放化疗后,采用程序性细胞死亡配体1 (PD-L1)抑制剂度伐利尤单抗进行巩固治疗的PACIFIC方案已成为无法手术的III期非小细胞肺癌(NSCLC)患者的标准治疗方案。然而,大约一半接受治疗的患者在1年内出现疾病进展,对治疗耐药的机制知之甚少。我们在这里进行了一项全国范围的前瞻性生物标志物研究,以探索耐药机制(WJOG11518L/SUBMARINE)。
方法:共纳入135例接受PACIFIC方案的无法手术切除的III期NSCLC患者,通过免疫组织化学、转录组分析、预处理肿瘤组织基因组测序以及循环免疫细胞流式细胞术分析,对肿瘤微环境进行全面分析。基于这些生物标志物比较无进展生存期(PFS)。
结果:无论基因组特征如何,肿瘤中预先存在的有效适应性免疫的重要性都揭示了治疗益处。我们还发现癌细胞的cd73表达是对PACIFIC方案的一种抵抗机制。以关键临床因素为协变量的免疫组织化学数据的多变量分析表明,CD8+肿瘤浸润淋巴细胞(TILs)密度低和CD73+癌细胞高与度伐单抗预后差独立相关(hr, 4.05 [95% CI, 1.17-14.04];CD73为4.79 [95% CI, 1.12-20.58])。此外,配对肿瘤样本的全外显子组测序表明,由于新抗原的可塑性,癌细胞最终逃脱了免疫压力。
结论:我们的研究强调了功能性适应性免疫在III期NSCLC中的重要性,并暗示CD73是一个有希望的治疗靶点,因此为发展非小细胞肺癌的新治疗方法奠定了基础。
引 言
非小细胞肺癌(NSCLC)由于其复发和转移的特点,是世界范围内癌症相关死亡的主要原因。III期疾病约占所有新诊断NSCLC病例的30%,大多数患者在诊断时无法手术切除的。III期NSCLC的主要治疗方法是明确的同步放化疗(dCCRT),但治疗结果并不令人满意,因为大多数患者最终经历了全身转移,尽管治疗前明显没有这种转移。最近的一项大型III期研究PACIFIC试验显示,在dCCRT (PACIFIC方案)后,使用免疫检查点抑制剂(ICI)度伐利尤单抗 (阻断程序性细胞死亡-1 (PD-1)与其配体pd - l1之间的相互作用)进行巩固治疗,通过激活宿主肿瘤靶向适应性免疫,显著降低肿瘤复发,导致无进展生存期(PFS)率大约翻倍。
因此,PACIFIC方案最近已成为III期NSCLC的标准治疗方案。然而,即使采用度伐利尤单抗治疗,仍有超过一半的患者在1年内出现早期疾病进展,这突出了开发更好的治疗策略的必要性。阐明非小细胞肺癌对PACIFIC治疗方案的原发性耐药机制,可能会为此类策略的发展提供见解。
在IV期非小细胞肺癌中,ICI治疗的耐药机制已经得到了很好的研究。例如,肿瘤微环境(TME)特征——如癌细胞上低水平的PD-L1表达、淋巴细胞向肿瘤组织的浸润性差、低水平的肿瘤突变负担(TMB)提示低水平的新抗原呈递——已被确立为预测早期治疗失败的生物标志物。这些特征被认为间接反映了宿主T细胞无法识别癌细胞。然而,在III期NSCLC的PACIFIC方案中,这些经典生物标志物的相关性仍然不明确。4此外,临床前数据表明,PACIFIC方案的成功被认为是由于PD-1/PD-L1抑制和dCCRT的协同作用。临床前研究表明,几种细胞毒性化疗或放射治疗可诱导免疫原性细胞死亡(ICD)。其特点是从癌细胞中释放损伤相关分子模式(DAMPs),随后有效募集和激活抗原呈递细胞(APCs),如巨噬细胞和树突状细胞,这是触发T细胞适应性抗肿瘤免疫所必需的。
APCs需要高迁移率组盒-1 (HMGB-1)和ATP等DAMPs作为“寻址信号”,以确定其目标位点。此外,接受ICD的癌细胞暴露于钙调钙蛋白作为“吃掉我”的信号,会触发APCs的吞噬作用。因此,这些临床前证据表明,ICD诱导剂最终通过这些机制促进ICIs对T细胞的活化。然而,研究也表明,各种分子阻止ICD,从而可能使肿瘤抵抗dCCRT和ICIs的协同作用。因此,由T细胞和癌细胞表达的TIM-3 (T细胞免疫球蛋白和粘蛋白结构域-3)被证明可以捕获HMGB-1,从而将apc排除在TME之外。此外,外核苷酶CD39和CD73降解响应dCCRT的癌细胞释放的ATP,导致腺苷的产生,从而抑制T细胞的活性,并导致不利的TME,其特征是结缔组织增生基质和原蛋白性骨髓细胞的存在。这些酶主要由癌细胞或调节性T细胞(Tregs)表达。癌细胞表达的CD47也通过下调钙网蛋白激活的CD91通路来保护细胞免受APCs的吞噬。这些不同的机制可能有助于非小细胞肺癌对PACIFIC方案的脱敏,但它们在临床免疫治疗方面的作用仍未得到充分研究。
在此背景下,我们进行了一项多机构前瞻性生物标志物研究(SUBMARINE/WJOG11518L),以探索III期NSCLC对PACIFIC方案的耐药机制。我们基于对PACIFIC治疗前后获得的包括肿瘤组织和外周血在内的临床样本的分析结果,阐明了III期NSCLC的TME及其与治疗效果的关系。
材料与方法
研究设计
这一基础性研究(WJOG11518L;试验标识符,UMIN000035916)是一项多中心前瞻性观察性研究,旨在探索不可切除的III期非小细胞肺癌患者dCCRT后对度伐单抗的耐药性机制。该研究在西日本肿瘤研究组(WJOG)的41个研究点进行,并符合方案和赫尔辛基宣言。每个机构的伦理委员会都批准了完整的方案和知情同意书。所有患者在进入研究前提供书面知情同意书。
该研究的主要目的是评估关键生物标志物与PFS的关系。生物标志物是根据PD-1/PD-L1抑制剂联合细胞毒性治疗的耐药机制的先前临床或临床前原理预先确定的。总之,包括CD39、CD47、CD73和TIM-3在内的几种免疫检查点分子被认为可以预防肿瘤细胞的ICD。11,12肿瘤细胞中HMGB-1释放不足也被认为是导致ICD不足的原因。此外,研究表明,表达PD-L2的肿瘤细胞可能逃避PD-L1抑制诱导的免疫激活。经典TME谱包括PD-L1表达、TMB和CD8+或叉头盒P3 (FOXP3)+肿瘤浸润淋巴细胞(TILs)密度。最小随访期为1年。根据PACIFIC试验数据,假设度伐利尤单抗的1年PFS率为56%,为了确保1年PFS率的95%置信区间(CI)下限>47%,将所需样本量计算为129例最终计划样本量为135例患者,考虑到潜在的退出和停药。
补充方法中提供了患者资格、临床数据和样本收集的详细信息,以及免疫组织化学(IHC)、下一代测序(NGS)、全外显子组测序(WES)、基因表达谱(GEP)、ELISA和多色流式细胞术(FCM)的方法以及统计分析。补充数据1显示了癌症细胞或免疫细胞中每个蛋白质的代表性IHC染色模式。
FCM所用抗体和代表性门控策略的详细信息在补充数据2和补充数据3。关键生物标志物的临界点如补充数据4所示。
结 果
患者特征
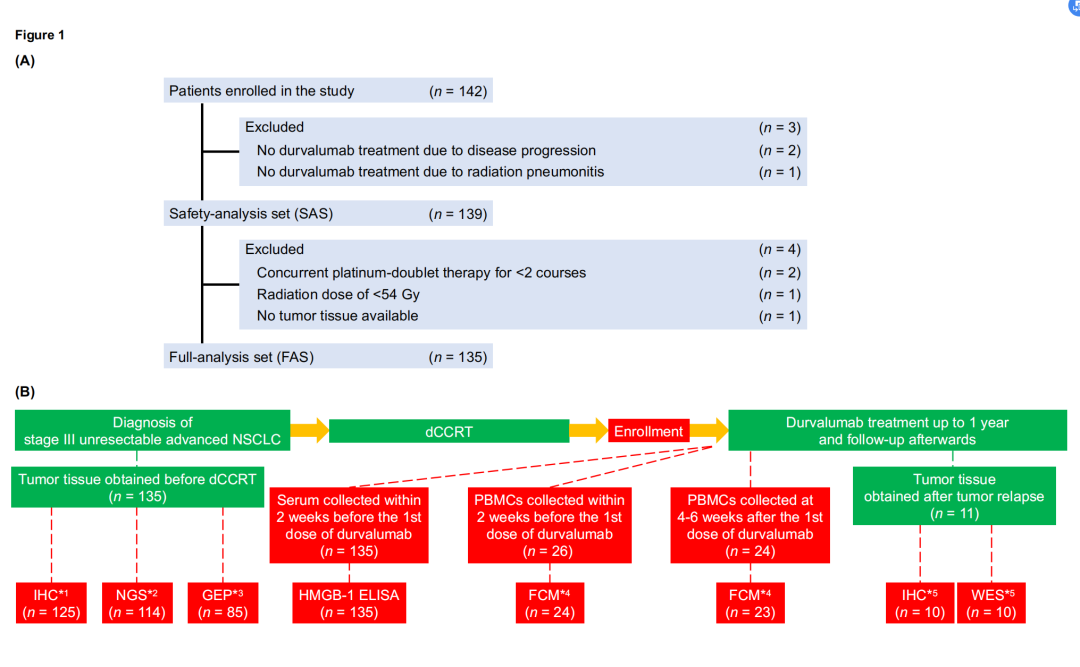
在2018年4月至2020年2月期间,根据预先确定的标准,排除了7名不符合度伐单抗疗效最终分析标准的患者后,135名患者作为主要目标的完整分析集(FAS)进行了疗效分析。患者选择和样本采集的详细情况如图1所示。
135例患者的临床特征见补充资料5。在临床实践中,约60%的参与者检测了EGFR突变或ALK融合基因。中位随访时间14.4个月,中位PFS为14.9个月。1年PFS率为56.3%,95% CI的下限为47.3%,超过了预期阈值。1年总生存率(OS)为86.7%。PFS和OS的生存曲线见补充数据6。考虑到影响度伐利尤单抗治疗效果的临床背景因素仍不明确,对所有预先确定的临床感兴趣的患者特征进行Cox比例风险回归分析(见补充方法)。预先设计的多变量分析涉及几个临床因素,包括吸烟史,鳞状组织学,EGFR突变或ALK融合基因,高衍生中性粒细胞与淋巴细胞比率(dNLR),延迟开始度伐利尤单抗治疗,以及对先前dCCRT的最小反应作为度伐利尤单抗治疗结果的潜在负面因素(HR >2.0)(补充数据7)。
经典TME
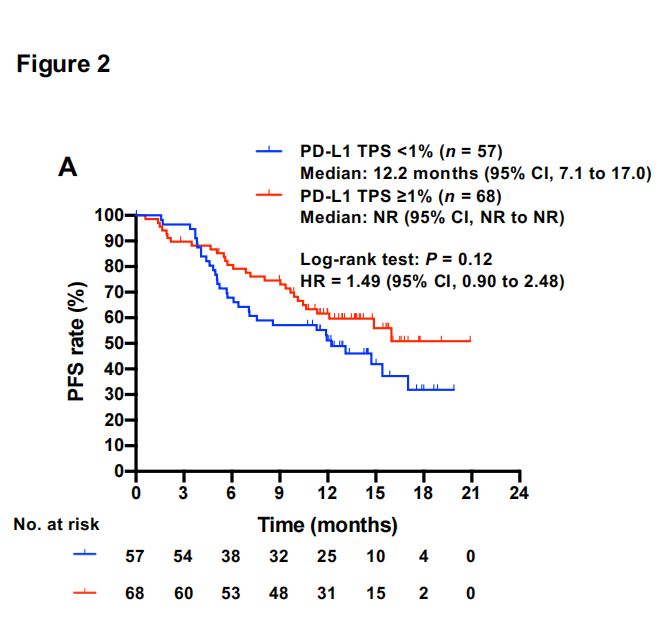
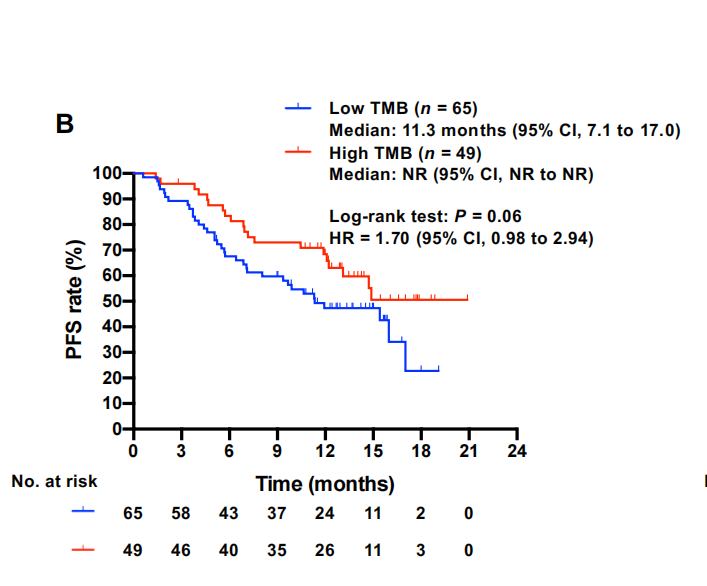
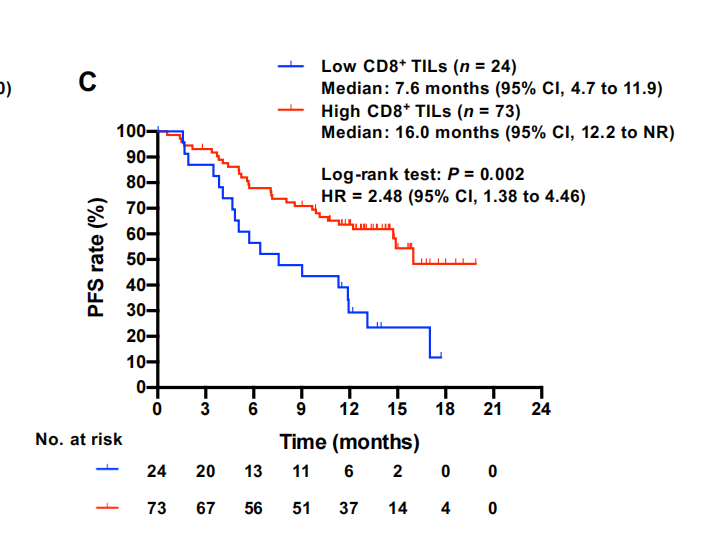
PD-1和CD8+TIL的配体通过IHC评估,TMB通过靶向NGS确定。低PD-L1肿瘤比例评分(TPS)与较短的PFS适度相关,无论临界值如何[HR,1.49(95%CI,0.90–2.48)表示1%;1.69(95%CI,0.91–3.13)表示25%;1.48(95%CI)表示50%](图2A)。鉴于最近在欧洲临床实践指南中,基于对PACIFIC试验的事后分析,1%的PD-L1 TPS被认为是临床上重要的临界值,在我们的研究中,该水平被用于后续分析。低TMB也与较短的PFS适度相关[HR,1.70(95%CI,0.98–2.94)](图2B)。与PD-L1抑制剂杜瓦鲁单抗对表达PD-L2的癌症细胞阻断PD-1轴的假设相反,尽管PD-L2阳性患者的数量较少,但癌症细胞中PD-L2高水平表达与杜瓦鲁单抗20、21的耐药性无关,而是与更好的PFS相关值得注意的是,低CD8+TIL密度与早期疾病进展密切相关[HR,2.48(95%CI,1.38-4.46)](图2C)。PD-L1 TPS与CD8+TIL密度相关,可能是由于CD8+ITL分泌的IFN对癌症细胞PD-L1表达的贡献。鉴于癌症细胞上PDL1的表达可能反映了他们之前接触过I型或II型干扰素,并且TMB是癌症细胞抗原性的间接标记,24这些数据表明,初始免疫原性低,特别是CD8+TILs数量不足,导致PD-1/PD-L1阻断治疗的原发性耐药,即使在有效的免疫原性治疗如dCCRT之后给药时也是如此。
ICD相关的生物标志物
采用ELISA或免疫组化检测icd相关生物标志物。dCCRT后的高血清HMGB-1浓度可能表明有效诱导了ICD,但与更好的PFS无关,反而与更差的结局相关[HR, 1.71 (95% CI, 1.00-2.91)],表明仅诱导ICD不足以使III期NSCLC肿瘤对PD-1/PD-L1阻断治疗敏感。CD47或TIM-3在癌症细胞中的表达与疾病进展无关,这意味着
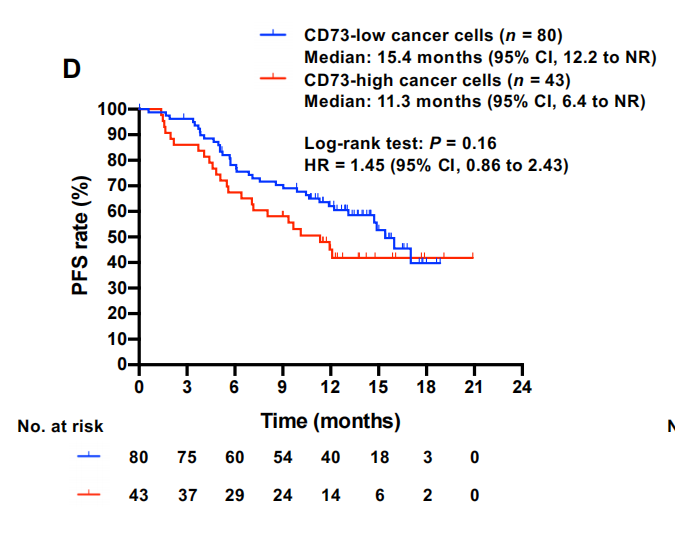
抑制吞噬作用和HMGB-1的释放不会促进癌症细胞的逃逸。来自PACIFIC方案刺激的免疫攻击。细胞中CD39的表达也与疾病进展无关。然而,值得注意的是,癌细胞中较高水平的CD73表达与较短的PFS中度相关[HR, 1.45 (95% CI, 0.86-2.43)](图2D)。鉴于CD39、CD73和TIM-3也作为免疫抑制分子被Tregs或耗尽的CD8+ T细胞表达16,25,26,我们评估了表达这些分子的瘤内淋巴细胞对度伐单抗疗效的影响。这些细胞上这些分子的表达均与疾病进展无关(补充数据9)。CD39+ TILs反而与更长的PFS相关[HR, 0.39 (95% CI, 0.17-0.92)],这与最近的研究一致,表明表达CD39的T细胞可能是新抗原反应性T细胞,有望具有较高的抗肿瘤活性。事实上,较高的CD39+ TIL密度与较高的CD8+ TIL密度密切相关。此外,定义为foxp3阳性TILs的瘤内treg也与更长的PFS相关[HR, 0.41 (95% CI, 0.23-0.75)],这与基于临床前数据提示免疫抑制功能的预期相反。值得注意的是,较高的瘤内Tregs密度与较高的CD8+ TIL密度密切相关,这与先前在IV期nsclc中的发现一致,这可能解释了为什么在我们的队列中,高Tregs密度与较好的PFS相关。
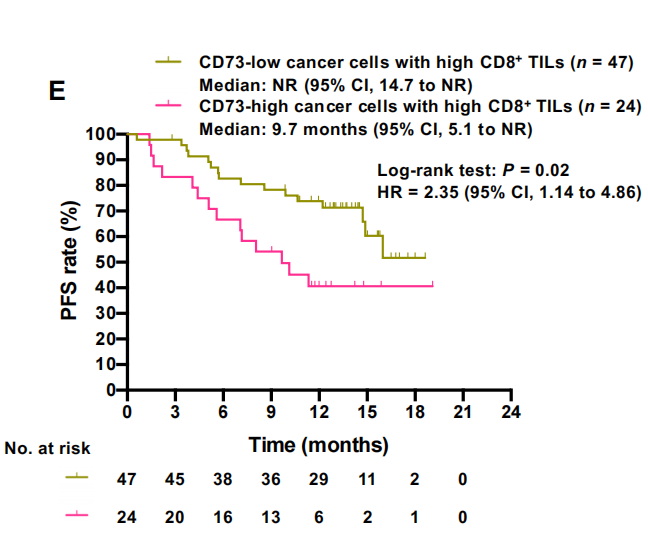
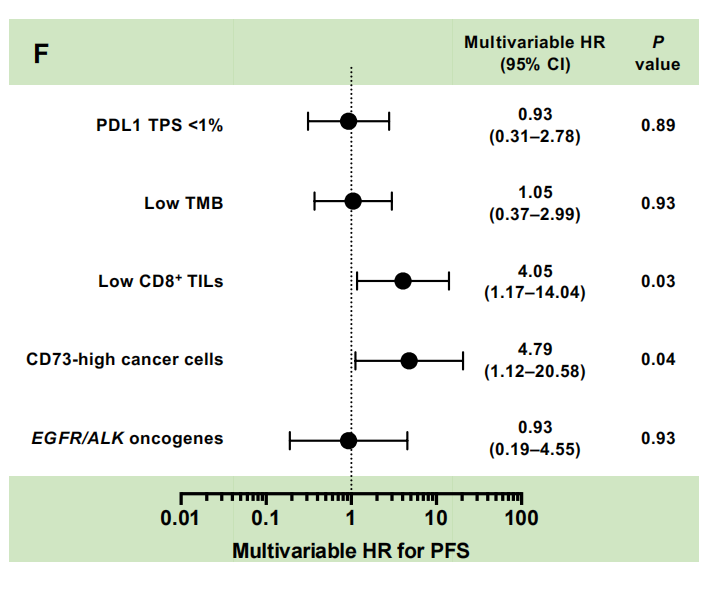
到目前为止,我们的数据表明,肿瘤中预先存在的免疫激活,如癌细胞上的PD-L1表达,高TMB和高CD8+ TIL密度是度伐单抗疗效的关键决定因素,并且表达cd73的癌细胞可能有助于度伐单抗耐药性。因此,我们进一步研究了表达cd73的癌细胞在这些经典TME谱中的可能作用。有趣的是,在CD8+TIL密度高的患者中,癌症细胞的CD73表达与疾病进展的关联更为显著[HR,2.35(95%CI,1.14-4.86)](图2E),而在CD8+TIL密度低的患者中没有观察到这种关联。然而,在PFS中,CD8+ TIL密度与PD-L1 TPS或TMB之间的类似相互作用并不明显(补充数据10D-G)。一项额外的多变量分析,证实癌细胞的低CD8+ TIL密度和高CD73表达与III期NSCLC在PACIFIC治疗期间的早期疾病进展独立且密切相关[低CD8+ TIL密度的HR, 4.05 (95% CI, 1.17-14.04);癌细胞CD73高表达的HR为4.79 (95% CI, 1.12-20.58)[图2F]。相比之下,在调整这些因素后,EGFR/ALK癌基因与早期疾病进展没有明显的相关性[HR, 0.93 (95% CI, 0.19-4.55)]。
鉴于组织学历来是非小细胞肺癌临床决策的重要决定因素,我们评估了TME谱与组织学的关系。在鳞状和非鳞状肿瘤中,PD-L1 TPS、TMB和CD8+ TIL密度均无差异,尽管在非鳞状NSCLC中,癌细胞中CD73高表达水平的肿瘤频率更高,这与以往的研究一致。然而,无论组织学亚型如何,癌细胞表达CD73与PFS的关联是一致的。事实上,在图2F中进行的多变量分析包括组织学作为协变量(非鳞状与鳞状),并显示组织学与PFS没有明确的关联,95% CI宽(HR为0.45,95% CI为0.11-1.85)。
总体而言,我们的研究结果表明,尽管dCCRT后通过PD-1/PD-L1抑制来控制肿瘤需要预处理免疫原性,特别是以CD8+ TILs的预先存在为特征,但癌细胞通过cd73相关机制抵抗免疫攻击。
免疫相关GEP
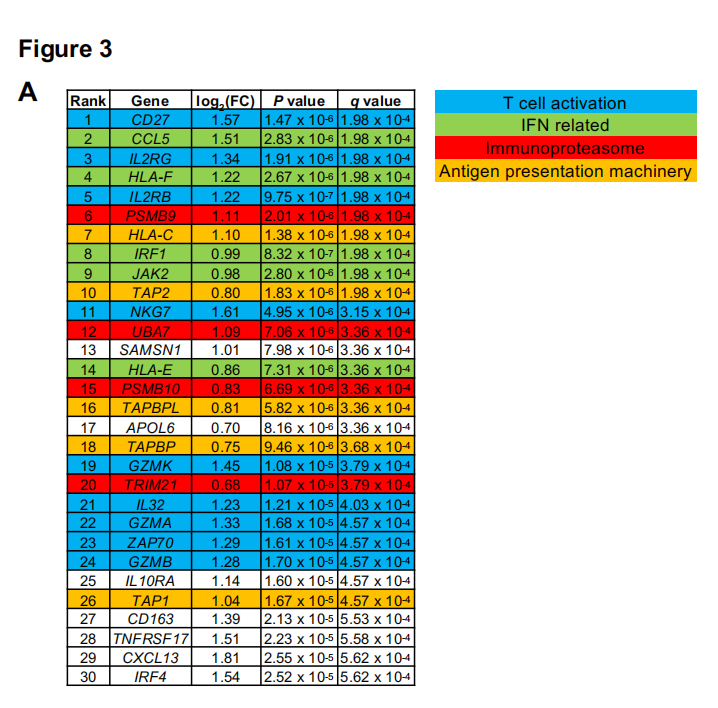
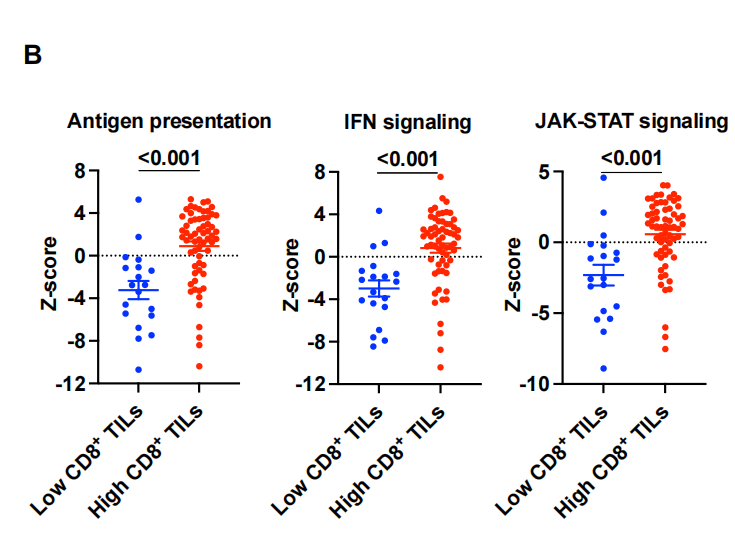
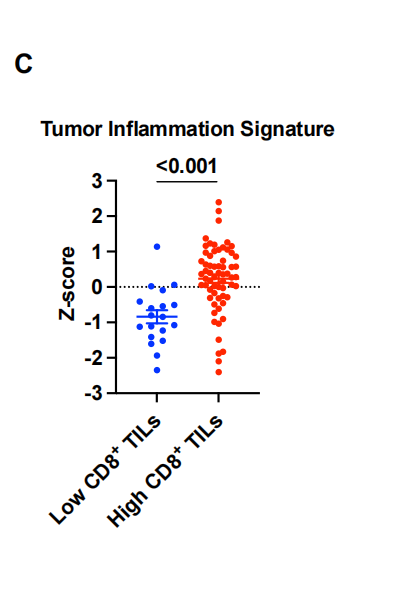
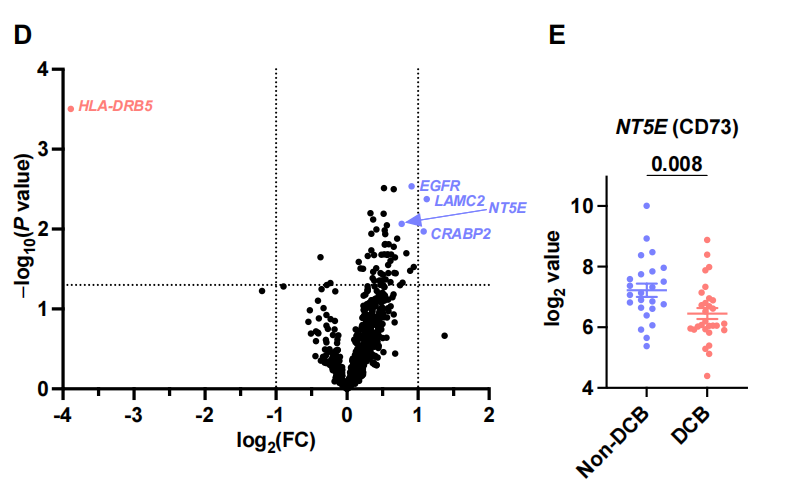
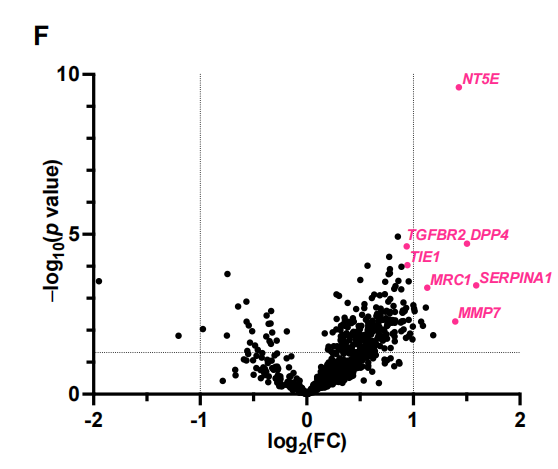
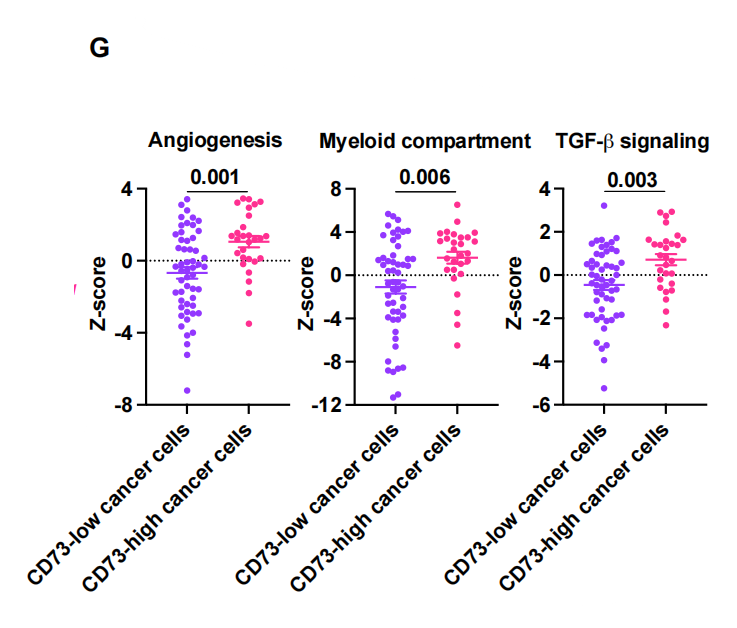
为了进一步剖析与度伐利尤单抗耐药相关的TME谱,我们使用nCounter IO360平台对肿瘤组织样本进行GEP预处理。我们首先研究了免疫组化评估的CD8+ TIL密度如何反映肿瘤内适应性免疫。差异基因表达分析显示,CD8+TIL密度与免疫蛋白酶体和抗原呈递基因的表达以及细胞毒性T细胞活性基因的表达密切相关。特征分析还显示,适应性免疫的基因集,如抗原呈递、IFN信号传导和JAK-STAT通路,与CD8+ TIL高密度相关而上调(图3B)。这些数据表明,通过免疫组化评估的CD8+ TIL密度代表了肿瘤中实质性的适应性免疫反应,这可归因于肿瘤反应性T细胞活性和癌细胞和apc的有效抗原呈递。事实上,低CD8+ TIL密度强烈预测肿瘤内适应性免疫不良,正如低肿瘤炎症特征(TIS)所提示的那样(图3C)。接下来,我们对具有高CD8+ TIL密度的肿瘤进行了基于PFS的差异基因表达分析,以确定即使在具有这种炎症肿瘤类型的患者中也负责早期疾病进展的基因(图3D)。在检测到的各种候选基因中,该分析显示NT5E(编码CD73)是与不良PFS相关的高表达基因,强调了CD73与治疗耐药的相关性。事实上,NT5E的表达水平在疾病早期进展的患者中明显更高[PFS <1年,非持久对照获益(DCB)](图3E),这与我们基于免疫结构的研究结果一致(图2)。接下来,我们通过免疫组化(IHC)评估CD73在癌细胞中的表达,比较预处理肿瘤组织的基因表达谱,以探索表达CD73的非小细胞肺癌对PACIFIC方案耐药的机制。火山图显示NT5E是癌细胞中与CD73表达相关性最强的基因(图3F),提示癌细胞是III期NSCLC中CD73表达的主要部位。在表达cd73的癌细胞的肿瘤组织中,其他高表达基因包括与癌症相关成纤维细胞(CAFs)、内皮细胞和肿瘤相关巨噬细胞(tam)相关的基因。事实上,基因集富集分析也表明,与血管生成和骨髓细胞相关的基因特征的表达与癌细胞中CD73的表达相关(图3G)。TGF-β信号特征的表达,预计与依赖CAF、TAM和异常血管生成的免疫抑制性TME相关,在癌症细胞中CD73高表达的肿瘤中也升高。这些数据与之前的临床前研究一致,表明CD73将CAFs和tam招募到TME中,并通过腺苷的产生促进肿瘤血管生成。
总之,这些发现表明,在肿瘤部位预先存在有效的适应性免疫系统是PACIFIC方案有效的先决条件,表达cd73的癌细胞赋予不利的TME,可能会损害度伐利尤单抗重新激活这种适应性免疫。
基因组概要
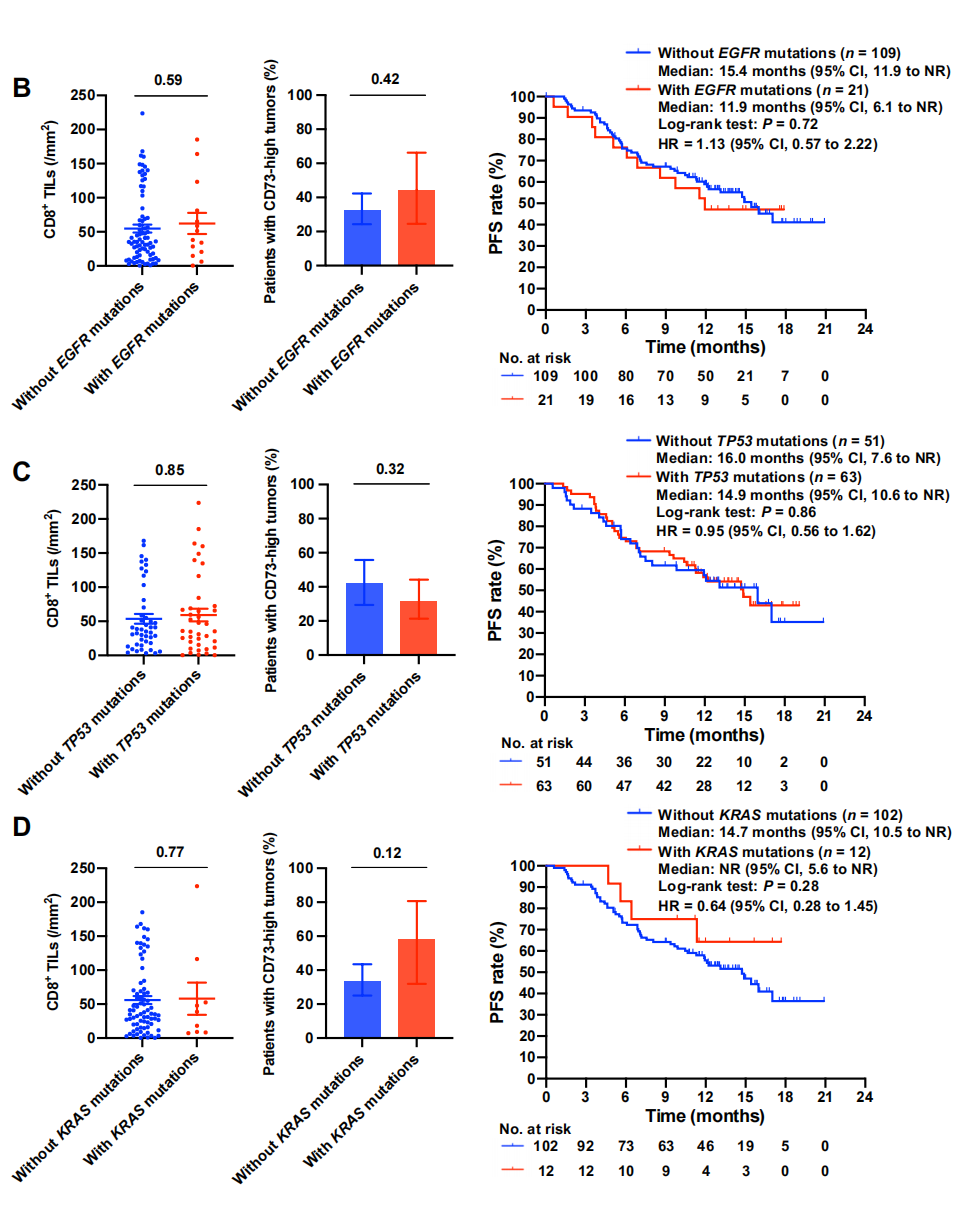
我们队列中III期NSCLC的基因组图谱如图4A所示。致病性改变最多的基因是TP53, EGFR的激活突变在日本人群中也很常见(分别为55%和17%)。第三种最常见的基因改变类型是激活KRAS突变(11%),但大多数此类突变不伴有STK11或KEAP1突变。我们研究了特定的基因改变是否可能与PACIFIC方案的疗效或特定的TME谱(包括CD8+ TIL密度或癌细胞的CD73表达)相关。本分析还考虑了临床实践中确定的EGFR突变状态,因此共评估了130例患者的该基因。EGFR、TP53和KRAS突变均与PFS或检测的生物标志物无关(图4B-D)。其他相对不常见的致病基因改变,包括PIK3CA、STK11、KEAP1、NFE2L2和ARID1A的基因改变,以及KRAS编码G12C突变蛋白的一种变体,这种变体在临床上可被化学共价抑制剂靶向治疗IV期NSCLC,也与PFS或生物标志物无关。此外,包括这些基因组改变作为协变量在内的多变量分析并没有揭示这些改变与 PACIFIC方案中度伐单抗疗效的关联性。
此外,考虑到我们的队列中一些EGFR突变阳性的患者呈鳞状组织,并且先前的研究表明,IV期NSCLC中更好的ICI疗效与吸烟史或鳞状组织有关,我们进行了亚组分析,比较了EGFR突变阳性的非鳞状NSCLC患者和有吸烟史和鳞状组织的EGFR突变阴性患者的PACIFIC方案的疗效。这两个临床不同亚群的PFS无明显差异。

PBMC动力学
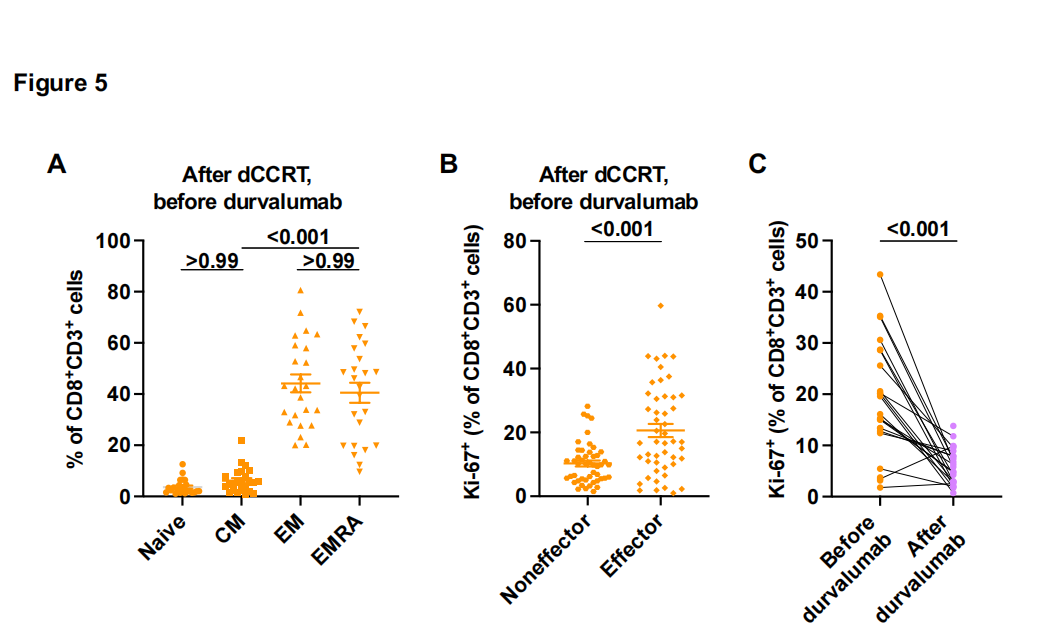
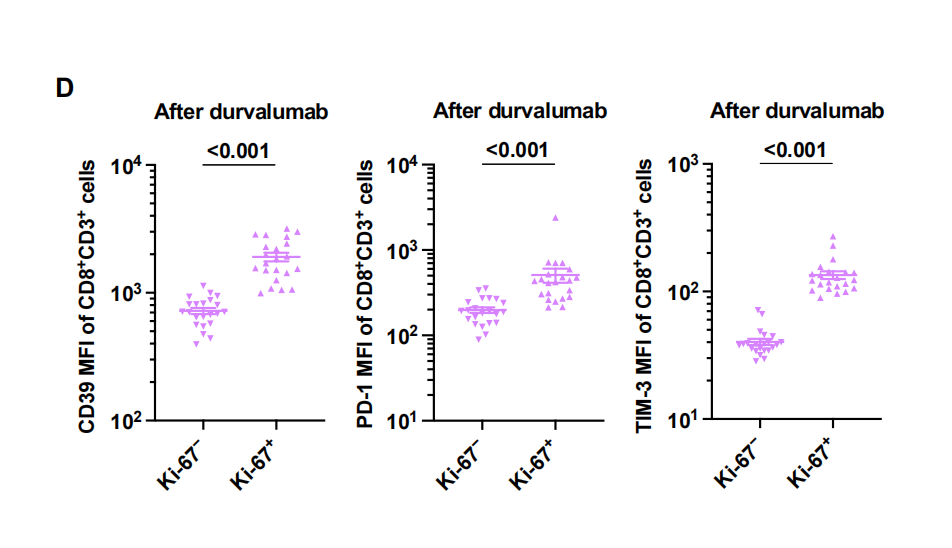
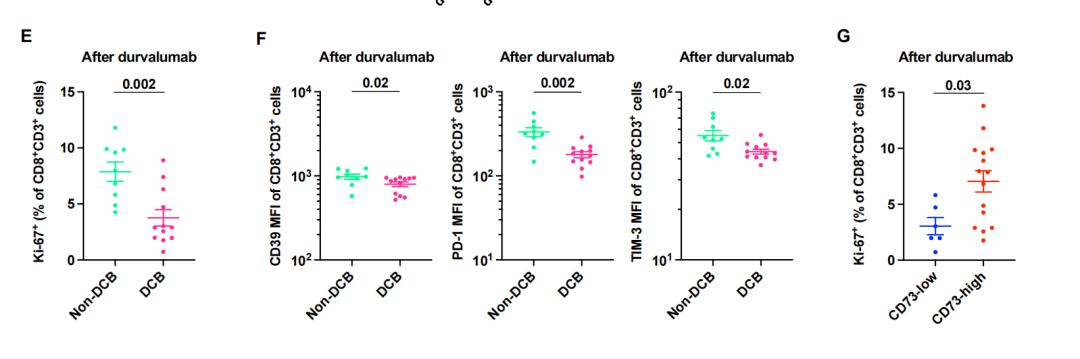
在度伐利尤单抗治疗开始前和开始后4至6周收集外周血单个核细胞(PBMC),使我们能够通过流式细胞术询问相关的PBMC动态。基于CCR7和CD45RA表达的CD8+ T细胞经典记忆表型分析显示,度伐单抗治疗前存在的大多数循环CD8+ T细胞是CCR7 - CD45RA -[效应记忆(EM)]或CCR7 - CD45RA+ (EMRA)细胞,可能反映了dCCRT后III期NSCLC中CD8+ T细胞持续和近期暴露于其靶抗原(图5A)。事实上,与非效应细胞相比,这些效应细胞(EM或EMRA)表达增殖标志物Ki-67的水平更高(图5B),这也提示了最近的T细胞受体(TCR)刺激。值得注意的是,在度伐利尤单抗治疗开始后,CD8+ T细胞中的Ki-67表达与治疗前相比大大降低(图5C),可能是由于治疗过程中抗原负担的减少。事实上,在度伐利尤单抗治疗开始后存在的Ki-67+CD8+ T细胞表现出一种耗竭表型,其特征是CD38、CD39、PD-1、TIM-3和TIGIT(具有Ig和ITIM结构域的T细胞免疫受体)的表达更高(图5D,补充数据14A),这表明它们持续暴露于与残留癌细胞相关的循环肿瘤抗原。正如预期的那样,在度伐利尤单抗治疗开始后,这种具有持续Ki-67表达或耗尽表型的CD8+ T细胞在非DCB患者中更常见(图5E和5F),预计他们会保留更多残留的肿瘤抗原,尽管度伐单抗治疗前CD8+T细胞中Ki-67的表达与治疗结果无关。这些数据表明,在度伐利尤单抗治疗开始后的4至6周,通过监测增殖或耗尽的CD8+ T细胞,可以早期发现疾病进展。与这一观点一致的是,cd73高的癌细胞患者在开始度伐单抗治疗后,循环Ki-67+CD8+ T细胞持续存在。其他循环免疫细胞也被评估。在度伐利尤单抗治疗前存在的抗原呈递单核细胞和自然杀伤细胞(NK)或NKT细胞的数量与治疗结果无关(补充数据14C)。度伐利尤单抗的疗效也没有根据吞噬细胞的抑制检查点分子如信号调节蛋白(SIRP-α)和唾液酸结合Ig样凝集素-10 (siglece -10)的表达而有所不同。此外,度伐单抗的疗效与循环免疫抑制细胞(如骨髓源性抑制细胞(MDSCs)和Tregs)或循环T细胞(CD4+或CD8+)上CD73的表达无关。
PACIFIC方案治疗后疾病进展的TME概况
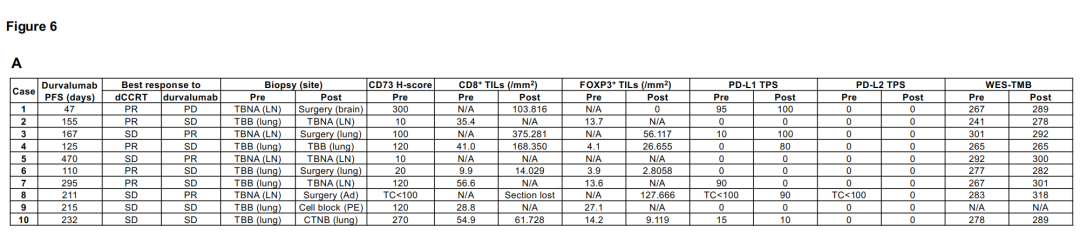
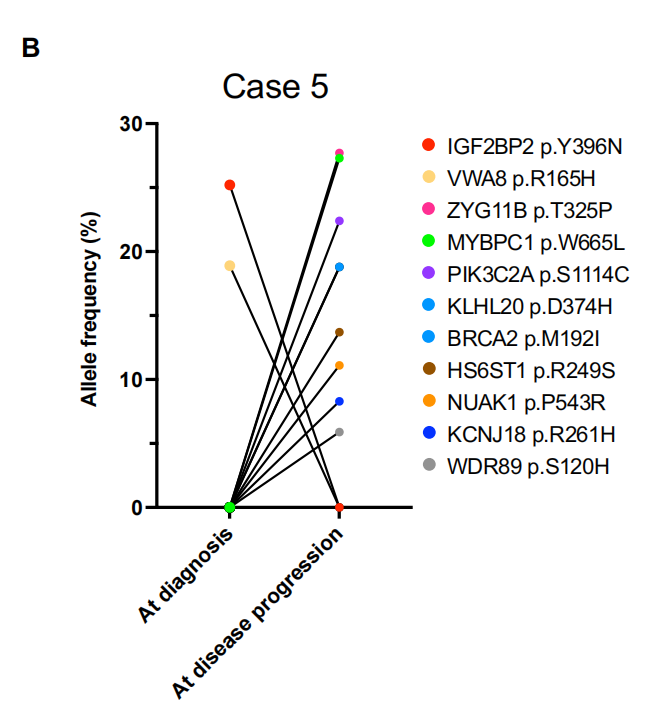
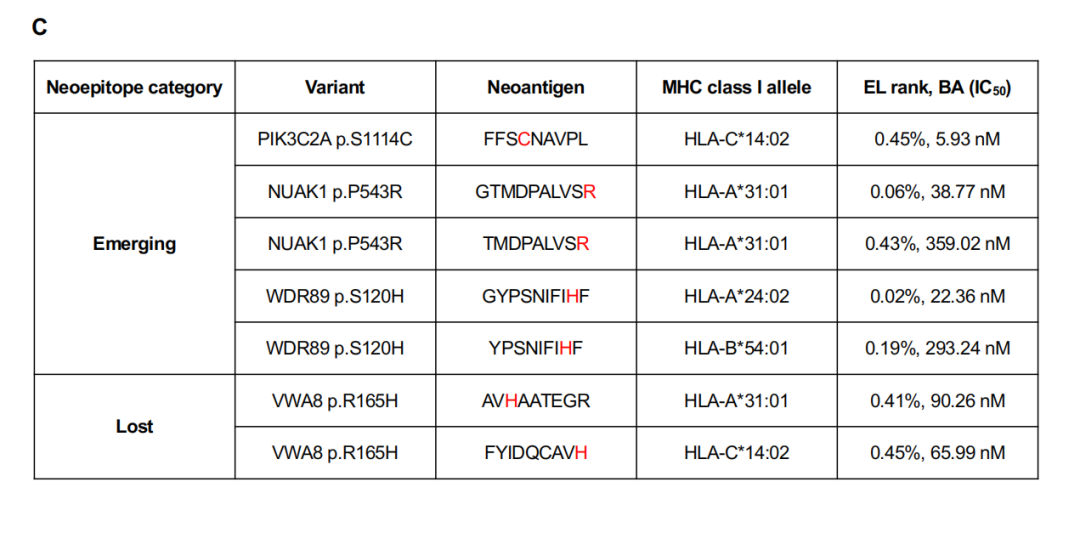
在PACIFIC方案治疗前和随后疾病进展后收集的10个配对肿瘤组织标本可用于分析。IHC分析和WES测定的TMB数据汇总于图6A。10例患者中大多数经历了早期疾病进展(1年内),因此被认为具有原发性耐药(非dcb)。事实上,大多数患者在接受PACIFIC方案治疗前癌细胞中CD73表达水平较高(h评分≥70)或CD8+ TIL密度较低(<15.398/mm2)。难愈的高cd73癌细胞患者即使在疾病进展中也表现出高CD8+ TIL密度,这表明表达cd73的癌细胞并不能阻止CD8+ T细胞的浸润,而是抵消了这些积累的T细胞的免疫攻击(见病例1、3、4和10)。病例5在疾病进展前表现出长期的疾病控制,提示这种进展是获得性耐药的结果。该患者治疗前cd73低,TMB在10例患者中排名第二,提示尽管肿瘤细胞上未检测到PD-L1表达,但预处理免疫原性是治疗成功的原因。PD-L2表达与治疗过程无关,由于活检类型(治疗前和治疗后样本的经支气管针吸),免疫细胞谱(如CD8+ TIL密度)的数据不可用。即使在产生耐药性后,TMB仍然很高。基于假设癌细胞在治疗过程中会失去免疫原性,从而逃避度伐利尤单抗重新激活的免疫攻击,我们检查了WES获得的突变谱,以评估该患者免疫原性可能发生的变化。配对WES分析显示,在治疗期间获得了9个体细胞非同义突变,失去了2个体细胞非同义突变(图6B)。然而,这些突变都不被认为与免疫相关或影响蛋白质功能,因为它们尚未被报道为致病性变异,因此它们不太可能是获得性耐药性的原因。因此,我们检查了预测的癌细胞呈现的新表位,在适应性免疫潜在靶向的四种蛋白质变体中发现了七个新表位(图6C)。VWA8 p.R165H的两个新表位在疾病进展中明显丢失(治疗前肿瘤中该变异的等位基因频率为18.9%),这表明肿瘤可能在使用PACIFIC方案治疗期间通过丢失具有这种免疫原性新抗原的亚克隆群体来适应免疫压力。
VWA8蛋白的表达先前在NSCLC中被发现上调,这与这些新表位在治疗前表达的观点一致。五种潜在的新表位在疾病进展中出现频率很高,表明针对这些新抗原的适应性免疫细胞治疗有可能治疗这种耐药肿瘤。
讨 论
从历史上看,癌症治疗过程中抗肿瘤疗效或疾病进展的特征特征对于开发新的治疗策略非常重要。
然而,尽管自首次报道PACIFIC方案的生存获益以来已经过去了五年多,但该疗法的生物标志物和耐药机制尚未得到很好的表征。为了解决这个问题,我们在一项来自日本大量研究所的135名患者的前瞻性研究中,通过基于IHC、GEP和NGS的综合分析,试图探索与PACIFIC方案耐药相关的特定TME概况。此外,关注与ICD概念相关的临床前证据所告知的特定标志物是我们研究的一个独特之处。我们预先设计的免疫组化分析得到了GEP对TME谱的详细解释的支持,这表明癌细胞中CD8+ TIL密度低和CD73表达水平高是对PACIFIC方案耐药的独立原因。此外,基因组分析显示,无论是否存在与NSCLC相关的常见基因改变,PACIFIC方案都具有一致的治疗益处。对度伐利尤单抗治疗前后获得的配对PBMC和肿瘤标本的探索性分析也为PACIFIC方案诱导的免疫动力学提供了见解。我们的研究结果将促进患者分层,为未来新治疗策略的发展以及当前的临床实践提供帮助。
我们的前瞻性研究是一项观察性研究,在临床实践中给予度伐利尤单抗,从而为PACIFIC方案提供真实数据。值得注意的是,本研究的生存结果与PACIFIC试验的初始报告相似。虽然临床特征与度伐单抗疗效之间的关系并不是我们研究的主要目的,但我们的数据在这方面提供了一些见解。EGFR/ALK癌基因被认为是IV期非小细胞肺癌患者对ICI治疗反应较差的原因,其是否与PACIFIC方案的疗效有关是临床关注的问题。在PACIFIC试验中,EGFR/ALK癌基因患者的PFS亚组分析显示,与这些基因的野生型患者相比,HR略为不利。然而,EGFR/ALK癌基因患者的数量很少,因此数据没有决定性。最近的回顾性研究表明,EGFR突变患者的临床获益在PACIFIC方案中有所降低。在我们的队列中,对关键因素进行调整后,EGFR/ALK癌基因与不良PFS没有明确的关联。此外,全面的基因组分析使我们能够增加EGFR突变阳性患者的检查数量,并证实度伐利尤单抗在该亚组中具有实质性的临床益处。目前,基于EGFR抑制剂(奥西替尼)的dCCRT后巩固治疗正在进行EGFR突变阳性III期NSCLC的III期LAURA试验。我们的数据强调了临床挑战,即奥西替尼或度伐单抗是否是该患者亚群的最佳治疗方法,特别是对于那些肿瘤在癌细胞中具有大量CD8+ TILs和低CD73表达的患者。对于IV期非小细胞肺癌,在EGFR突变的肿瘤中,以PD-L1低表达或CD8+ TIL低密度为特征的免疫原性TME谱被认为是这些肿瘤对ICI治疗低敏感性的原因。有趣的是,在我们的III期NSCLC数据集中,CD8+ TIL密度在有或没有EGFR突变的肿瘤之间没有差异,这可能解释了相同的治疗结果。正如我们之前所显示的,即使在IV期NSCLC中,具有炎症性TME特征的EGFR突变阳性患者的特定亚群也可以从ICI治疗中受益。需要进一步的研究来阐明TME谱在这一子集中的作用。此外,对包括其他基因组改变在内的NGS数据的进一步分析表明,不能仅根据特定的基因组特征来预测PACIFIC方案的疗效。需要注意的是,我们的NGS是基于多重聚合酶链反应试验,因此可能导致拷贝数变化的低检测。对更多患者个体基因组特征的进一步研究应该有助于揭示对治疗结果的任何微妙影响。我们的研究强调了TME谱作为未来研究的基本参数的重要性。
除了与ICD相关的探索性生物标志物外,我们还评估了经典的TME谱。PD-L1 TPS是经PD1/PD-L1抑制剂治疗的IV期非小细胞肺癌的既定生物标志物,关于PACIFIC方案,该生物标志物在III期NSCLC中的临床作用尚不清楚。PACIFIC试验的一项亚组分析表明,PD-L1 TPS <1%的患者不太可能获得度伐单抗治疗的生存获益,尽管由于分析的post - hoc性质,这些数据尚无定论。我们的数据显示,低PD-L1-TPS与较差的PFS有类似的趋势。然而,在调整临床因素和其他关键生物标志物后,这种关联变得不那么明显。因此,鉴于PD-L1-TPS似乎反映了CD8+ TIL密度所代表的免疫原性(如补充数据8C所示),尽管低PD-L1-TPS可能仍然是一个实用的分层因素,但PD-L1 TPS不应被认为是IV期NSCLC的一个强有力的生物标志物。越来越多的证据支持使用CD8+ TIL密度作为与ICI疗效相关的预处理免疫原性的标记物。事实上,预处理CD8+ TIL密度是我们研究中最重要的生物标志物,GEP表明,它始终代表癌细胞的免疫原性,这反映在控制癌细胞对T细胞攻击易感性的基因的表达增加(如与免疫蛋白酶体、抗原呈递和JAK-STAT途径相关的基因)。而先前的研究表明,dCCRT可能会增加癌细胞的免疫原性。我们的数据显示,没有预先存在CD8+ TILs的肿瘤对PACIFIC方案的持久反应可能性要小得多,这表明在这些病例中,先前的细胞毒性治疗不能产生基本的免疫原性。有效治疗这种低免疫原性肿瘤将需要开发其他策略来支持ICI治疗,例如针对未识别抗原的工程免疫细胞疗法。另外,非ICI治疗方案,如分子靶向治疗包括奥西替尼可能是合理的。ICD的概念已被提出作为细胞毒治疗和ICI治疗之间协同作用的关键机制,主要基于临床前研究。我们的研究表明,癌细胞中ATP降解酶CD73的表达抵消了大量CD8+ TILs所赋予的免疫活性。与先前的数据一致,新抗原刺激的CD8+ T细胞倾向于表达CD39。我们还发现CD8+ TIL密度与TIL中CD39的表达相关。这些发现表明,正如之前的实验研究所暗示的那样,肿瘤细胞中CD39和CD73的表达可能促进这些细胞逃避新抗原反应性CD8+ T细胞的杀伤。这些免疫抑制酶产生的腺苷通过促进CAFs、tam和MDSCs的募集以及异常的血管生成而导致不利的TME,所有这些都可能降低ICI的疗效。
事实上,我们的GEP分析显示,与这些表型相关的基因表达与表达cd73的癌细胞有关,提示这些癌细胞在NSCLC中产生腺苷。鉴于我们的GEP数据是从dCCRT前收集的肿瘤样本中获得的,即使没有icd介导的ATP释放,CD39或CD73的表达也可能赋予对度伐利尤单抗的耐药性。在其他情况下,表达cd73的癌细胞是否也能介导对ICI治疗的耐药性还有待进一步研究。总的来说,这些数据表明CD73是一个有希望的治疗靶点。值得注意的是,最近的一项随机II期试验(COAST)显示,除PACIFIC方案外,CD73抑制剂oleclumab治疗的III期NSCLC患者的PFS更好。一项大型III期试验(PACIFIC-9)目前正在进行中,以测试奥来鲁单抗(NCT05221840)的额外益处。我们的研究为支持患者分层和对未来研究的解释提供了新的见解。
除了肿瘤组织谱外,我们还评估了度伐单抗治疗前后成对的PBMC表型。我们的数据表明,监测循环Ki67+CD8+ T细胞可以预测PACIFIC方案治疗期间的早期疾病进展。先前对IV期NSCLC患者的研究表明,循环Ki-67+CD8+ T细胞可能代表新抗原反应性T细胞53,54,这些增殖的T细胞也被发现表达衰竭标志物,如PD-1和CD38,我们的研究也观察到这一点。然而,我们意外地发现,在ICI治疗开始后,循环Ki-67+CD8+ T细胞的数量与治疗前相比明显减少,与先前IV期NSCLC的研究结果相反,先前的研究结果显示循环CD8+T细胞即使在ICI治疗开始后4周或更长时间仍继续以至少与基线相同的水平表达Ki-67。这种差异的一个可能解释是,在我们的研究中,在首次收集PBMCs之前进行了根治性放疗,因为在之前的一项研究中,之前的放疗可能与外周血中Ki-67+CD8+ T细胞异常高频的检测有关。事实上,在我们的研究中,大多数患者的CD8+ T细胞Ki-67阳性率>10%,在IV期NSCLC中很少检测到如此高的值。放射治疗后PBMCs中Ki-67+CD8+ T细胞如此高频率的机制尚不清楚,尽管先前的研究表明放射治疗增加了T细胞暴露于APC呈递的抗原的机会。在我们的研究中,在度伐利尤单抗治疗开始后,循环Ki-67+CD8+ T细胞的频率下降到IV期NSCLC通常观察到的水平,但这些细胞的数量下降不足,随后是疾病进展。总之,这些结果表明,残留的癌细胞诱导了持续的TCR刺激,随后CD8+ T细胞中持续的Ki-67表达,这与先前的数据一致,表明dCCRT后ICI治疗开始几个月后循环肿瘤DNA的持续存在也预测了最终的疾病进展。
迄今为止,只有有限数量的研究评估了长期接受ICI治疗后的获得性耐药机制,即使在IV期NSCLC中也是如此。一些这样的研究暗示了新表位呈递的损伤,例如由于新抗原的丢失或与抗原呈递机制或IFN信号通路相关的基因表达的丢失。
我们对长期应答者的详细分析也揭示了免疫原性新表位的缺失与对PACIFIC方案的耐药发展相关,提示即使在dCCRT后,III期NSCLC也存在类似的机制。新抗原的遗传丢失代表了肿瘤免疫原性的根本改变,因此不适合依赖于先前存在的T细胞克隆的治疗干预,正如先前对IV期NSCLC的研究所表明的那样。我们的数据进一步揭示了治疗后出现的几个免疫原性新表位,提高了靶向这些新表位的适应性细胞治疗作为后续选择的可能性。ICI耐药性发生后收集临床肿瘤标本通常具有挑战性,因为目前的临床实践通常没有必要这样做。然而,在治疗过程中这种免疫原性可塑性的发现凸显了治疗后重新评估肿瘤组织免疫原性对未来研究的重要性。
我们的研究有几个局限性。首先,它被设计为一项探索性研究,这使得我们的发现可能不是决定性的。因此,鼓励进一步的确证性研究。二是随访时间<2年;虽然这项研究最初的设计随访时间长达3年,但由于患者登记比预期的更顺利,研究提前完成。然而,考虑到该研究的主要目的是探索早期疾病进展的主要耐药机制,较短的随访时间可能足以达到这一目的。此外,PACIFIC试验的随访结果显示,1年或2年的PFS率反映了长期生存数据,这表明我们的发现也可能与长期生存结果一致。第三,在dCCRT和度伐利尤单抗治疗期间没有收集肿瘤组织,因为目前临床实践中很少有这样的采样。因此,dCCRT期间TME的变化可能影响了我们对研究结果的解释。我们的研究应该提供潜在的生物标志物,可以在dCCRT和PD-1/PD-L1抑制剂新辅助治疗的背景下进行评估。据我们所知,这是第一个评估基因组或TME谱与III期NSCLC PACIFIC方案预后相关性的大型综合研究。我们的研究结果表明,癌细胞中预先存在的低CD8+ TIL密度和高水平的CD73表达有助于对PACIFIC方案的原发性耐药。基因组谱与生存结果没有明确的关联。揭示了PBMC谱和肿瘤免疫原性与治疗结果相关的动态。因此,我们的发现应该为开发新的治疗策略提供基础。
翻译及审校:刘浩
END

长按二维码添加
关注我们 获取更多文献

点击“阅读原文”
原文地址:http://mp.weixin.qq.com/s?src=11×tamp=1688234065&ver=4624&signature=LyN9JhkBzd4VWe9oGM9BDkOnnhyeWNCNtcxSKOyTXDqNX*SXyGAynpfY6eawODneHbxSDGngVhy0v4gQt8DTmJfn0grz5ARB38VkDa0BXgDDDghOPQYc6agMLlcQipo1&new=1 |
|