|
|
作者:e药安全
肺友交流群、同行交流群(点击)
本文概要
非小细胞肺癌
靶向治疗
EGFR突变
1. 一项研究(新辅助):II期,奥希替尼,MPR率仅15%(未达预设终点),pCR率为0%
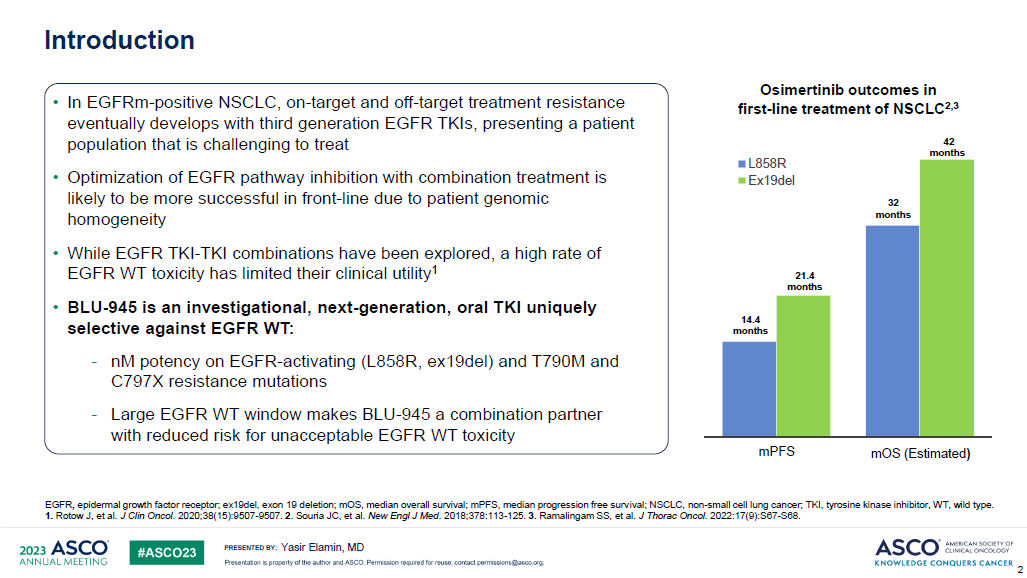
2. ADAURA研究(辅助):III期,奥希替尼±化疗 vs 化疗,5年OS率分别是85% vs 73%,获统计学意义延长
3. AGAIN研究(晚期):III期,吉非替尼/奥希替尼+化疗 vs 吉非替尼/奥希替尼,中位OS无差异
4. SYMPHONY研究(C797X耐药):I期,BLU-945 ± 奥希替尼,疗效有待提高,2期推荐剂量(RP2D)仍未确定
5. CHRYSALIS-2研究:I/Ib期,奥希替尼耐药,Amivantamab+Lazertinib,MET(3+)ORR达61%
EGFR 20ins
6. WU-KONG1、15研究:I/II,舒沃替尼,初治ORR达77.8%
免疫治疗
围术期免疫治疗
7. KEYNOTE-671研究:III期,K药+化疗→手术→K药维持 vs 化疗→手术,EFS获益;确立治疗新模式
8. Neotorch研究:III期,特瑞普利单抗围术期免疫治疗,EFS获益
晚期免疫治疗
9. TROPION-Lung02研究:Ib期,Dato-DXd+K药±铂类,双联、三联ORR分别为38% vs 49%
EGFR-TKI耐药
10. KEYNOTE-789研究:III期,K药+化疗 vs 化疗,PFS、OS均无差异
非小细胞肺癌-靶向治疗部分
EGFR突变肺癌丨EGFR突变靶向治疗系列研究汇总
新辅助靶向治疗
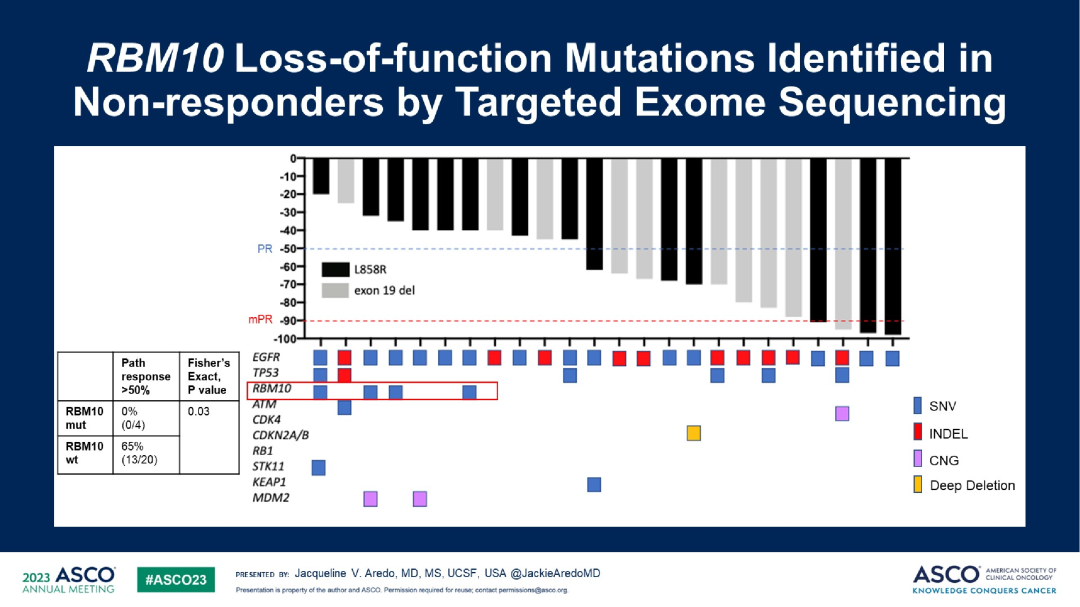
一项研究一项研究:这是一项多中心II期临床研究,评估奥希替尼用于新辅助治疗I-IIIA期(AJCC V7)EGFR突变NSCLC患者的疗效和安全性。纳入I-IIIA期可手术的EGFR敏感突变的NSCLC患者27例,患者在术前接受奥希替尼(每日80mg,口服)新辅助治疗,28天为1周期,最多2周期。主要终点是MPR率(预设终点MPR率:~50%),次要终点包括安全性和有效性。
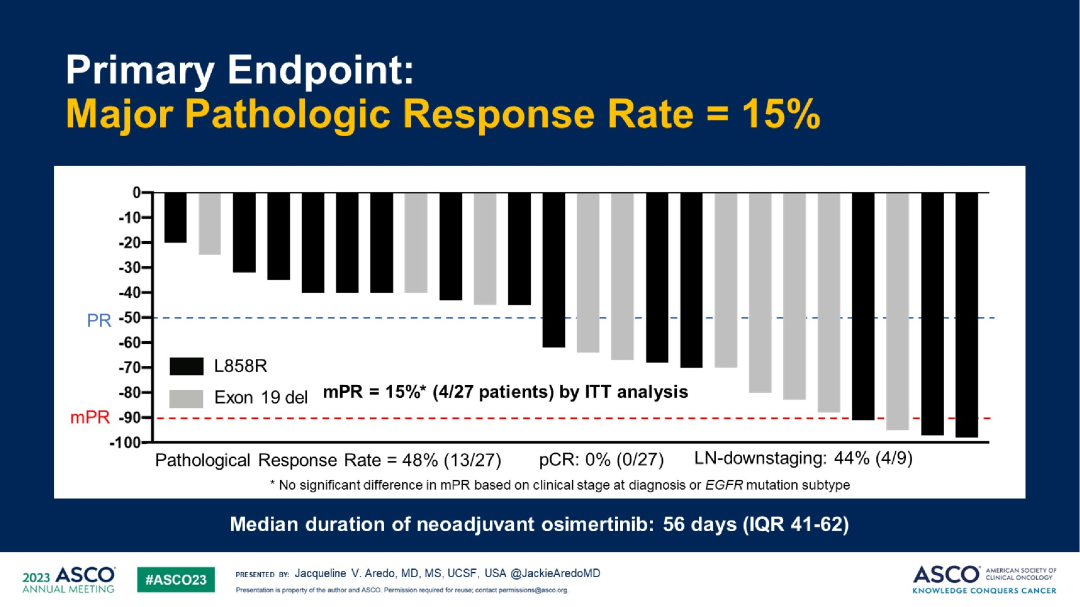
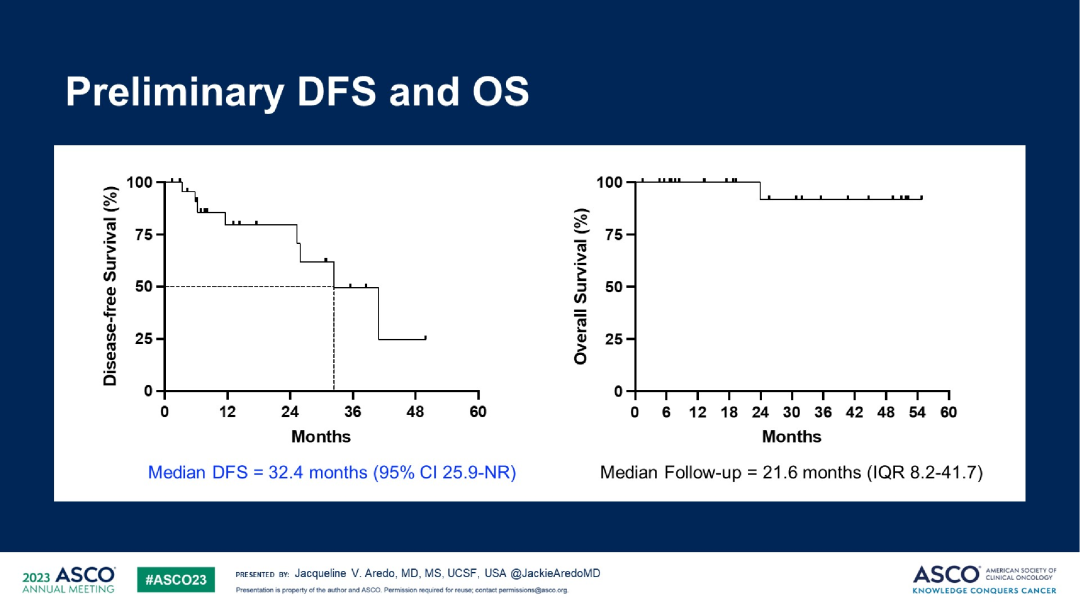
研究结果:最终89%的患者(24/27)接受手术治疗,而11%(3/27)的患者转为放化疗。中位接受奥希替尼新辅助治疗的时间为56天,主要病理缓解(MPR)率为15%,没有达到主要终点。部分病理缓解率为48%(13/27),pCR率为0%(0/27),淋巴结降期率为44%(4/9)。术后中位无病生存期(DFS)达32.4个月,总生存期(OS)尚不成熟。

探索性分析发现,残留病灶中存在RBM10功能缺失突变与治疗无应答相关;另外,残留病灶中YAP的基因表达增加,可能与肿瘤细胞存活相关。
辅助靶向治疗
ADAURA研究
NEJM丨肺癌,奥希替尼术后辅助治疗降低83%复发风险
ADAURA研究[1]:是一项3期、双盲、安慰剂对照、随机、国际性试验,旨在评估完全切除术后的ⅠB~ⅢA期EGFR突变阳性(Ex19del或L858R)NSCLC患者完成辅助化疗后(非必须,根据医师和患者的选择),使用奥希替尼的疗效和安全性,并与安慰剂进行了比较。符合入组的患者以1:1随机分组,分别接受奥希替尼(80 mg,每日一次)或安慰剂治疗,直至观察到疾病复发、试验治疗方案完成(3年)或符合停药标准。主要终点是研究者判定的Ⅱ-ⅢA期疾病患者无病生存率。次要终点包括ⅠB-ⅢA期疾病患者无病生存率、总生存率和安全性。本次会议报道了计划的总生存率最终分析结果。

研究结果:1)DFS,在本次OS分析结果发布前,最后更新(截至2022年4月,中位随访时间44.2个月)的DFS数据显示[2],II-IIIa期患者两组中位DFS分别为65.8个月和21.9个月,HR=0.23,48个月的DFS率分别为70%和29%;Ib-IIIa期患者中,两组中位DFS分别为65.8个月和28.1个月,HR=0.27。
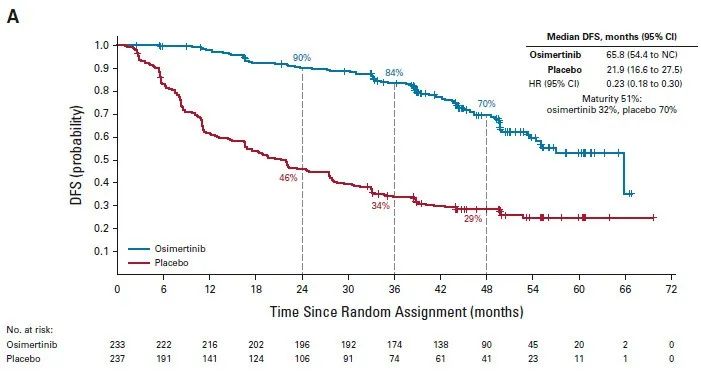
II-IIIa的DFS
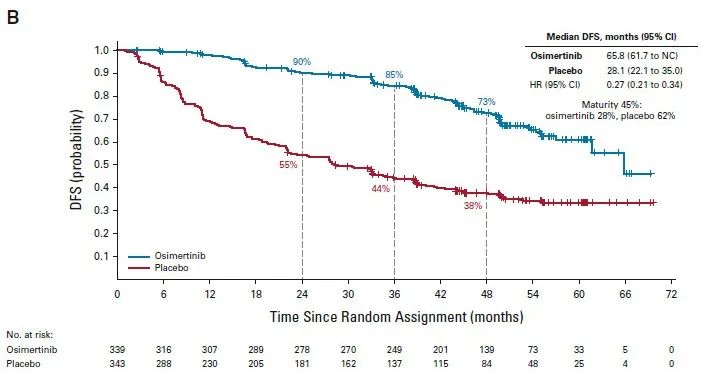
Ib-IIIa的DFS
2)OS,奥希替尼组和安慰剂组分别有339例和343例患者纳入本次最终OS分析,两组分别发生42和82例OS事件,数据成熟度为12.4%和23.9%,已符合研究预设的最终OS分析标准(Ⅱ-ⅢA期患者中发生100例OS事件,预设为约94例)。奥希替尼组和安慰剂组患者的中位OS均尚未达到,在Ⅱ至ⅢA期疾病患者中,奥希替尼组和安慰剂组5年OS率分别是85% vs 73%(HR=0.49,P<0.001);在总体人群(ⅠB至ⅢA期疾病患者)中分别为,88% vs 78%(HR=0.49,P<0.001)。
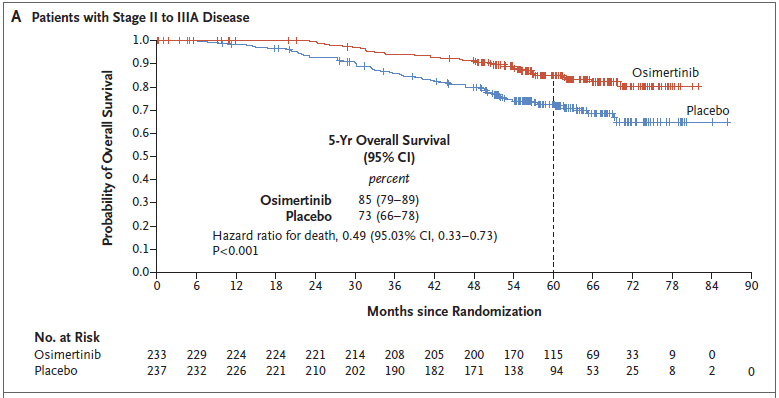
II-IIIA期OS曲线
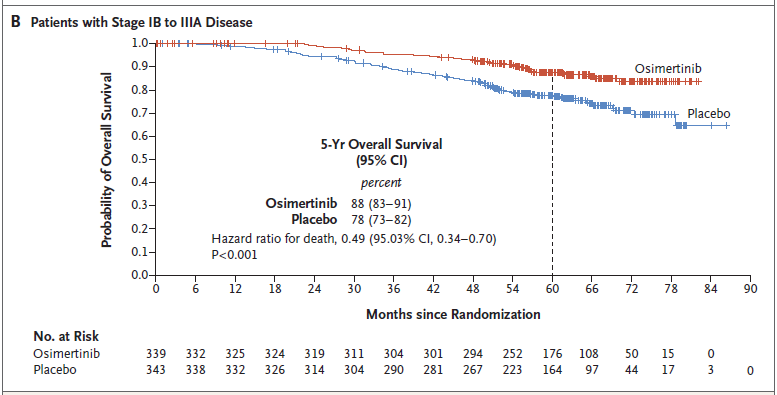
II-IIIA期OS曲线
亚组分析结果显示,奥希替尼辅助治疗的获益在各亚组中整体一致,无论患者是否接受过辅助化疗,均不影响奥希替尼治疗的OS获益。
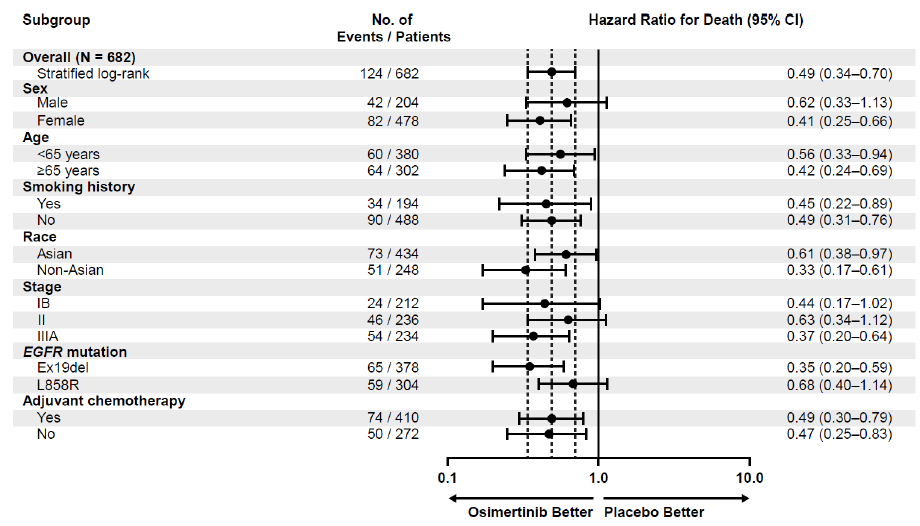
OS数据亚组分析
在之前公布的数据截止日期之后报告了一起新的严重不良事件(COVID-19相关肺炎)。研究者认为该事件与试验治疗方案无关,且患者完全康复。奥希替尼辅助治疗安全性与主要分析结果一致。
小结:在完全切除术后的EGFR突型ⅠB至ⅢA期NSCLC患者中,奥希替尼辅助治疗具有显著总生存获益。
晚期靶向治疗
AGAIN研究
AGAIN(JCOG1404/WJOG8214L)研究:一项开放标签、多中心、III期随机对照研究,对比了吉非替尼联合顺铂+培美曲塞或EGFR-TKI单药一线治疗EGFR突变非鳞非小细胞肺癌的疗效与安全性【研究假设加上化疗可以消除耐药的克隆】。研究纳入局部晚期或晚期EGFR敏感突变的非鳞状NSCLC患者,联合化疗组第1~56天接受吉非替尼或奥希替尼治疗,接着空窗2周,后第71、92和113天给予顺铂和培美曲塞3周期化疗,再第134天重新给予吉非替尼或奥希替尼直至疾病进展;靶向单药组接受吉非替尼或奥希替尼治疗直至疾病进展。主要终点是总生存期(OS)。
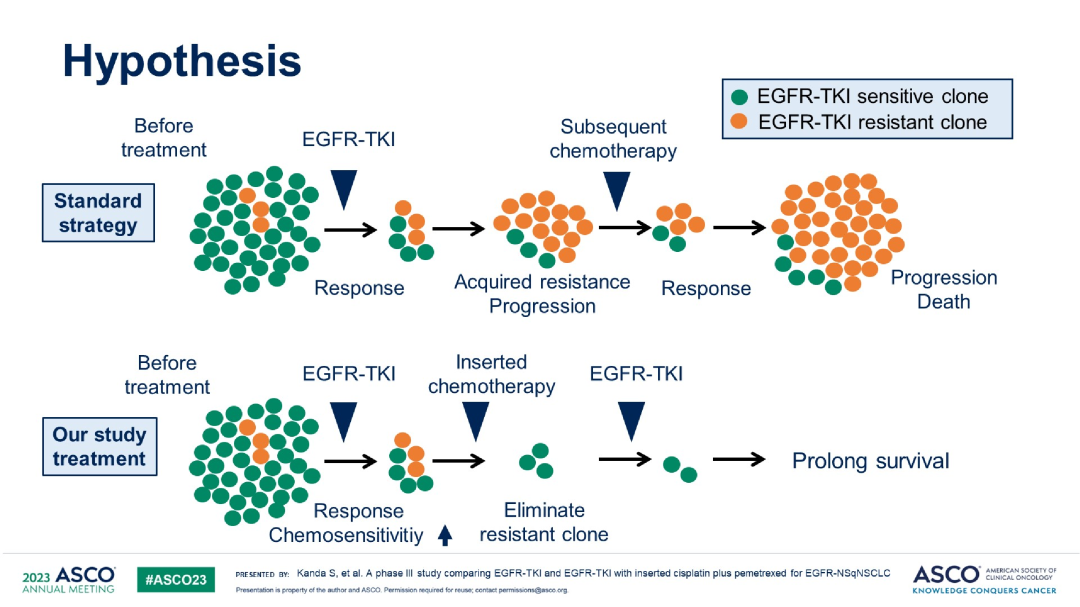
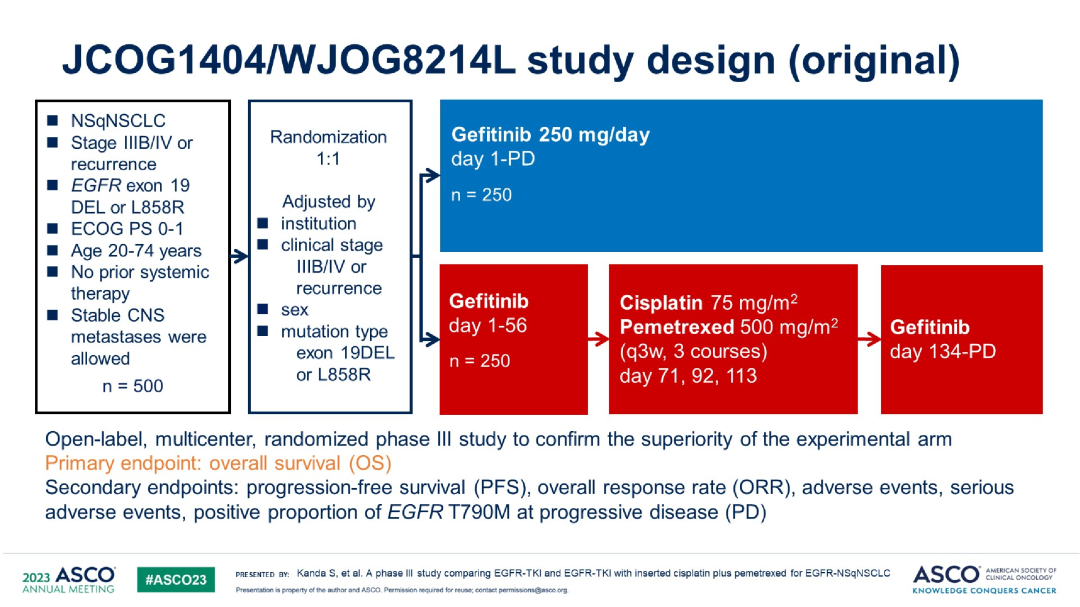

研究结果:共入组了501例患者,联合化疗组251例(153例吉非替尼,97例奥希替尼),单药靶向组为251例(155例吉非替尼,96例奥希替尼),基于FLAURA研究结果,2018年10月开始将EGFR-TKI从吉非替尼改为奥希替尼。两组中,基线脑转移占比为29.6% vs 27.1%。晚期和复发性疾病占比为85.2% vs14.8%,19del和L858R占比为55.2% vs 44.8%。
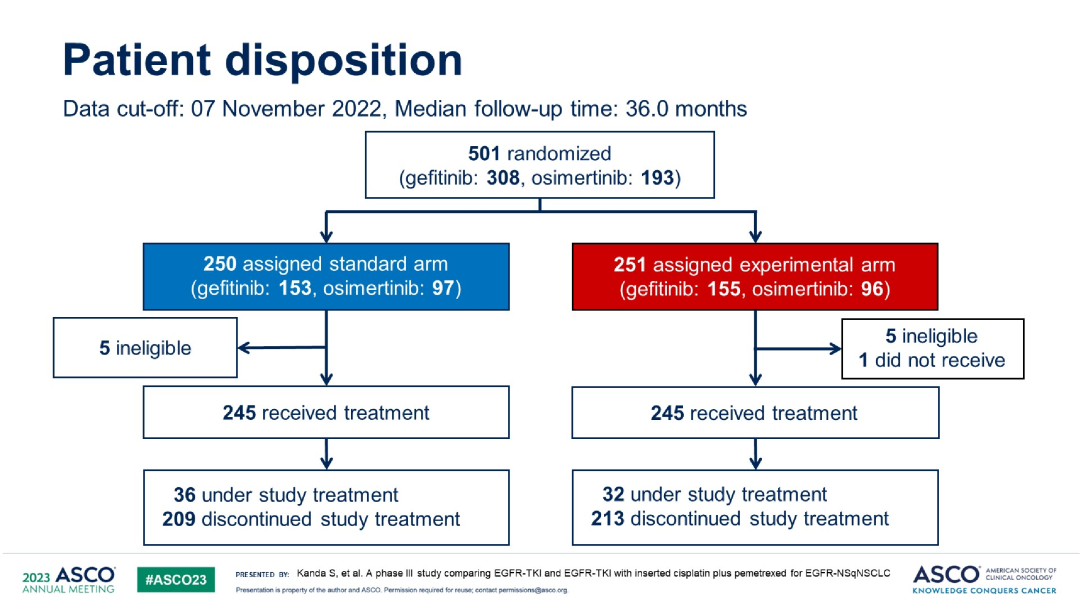
入组情况
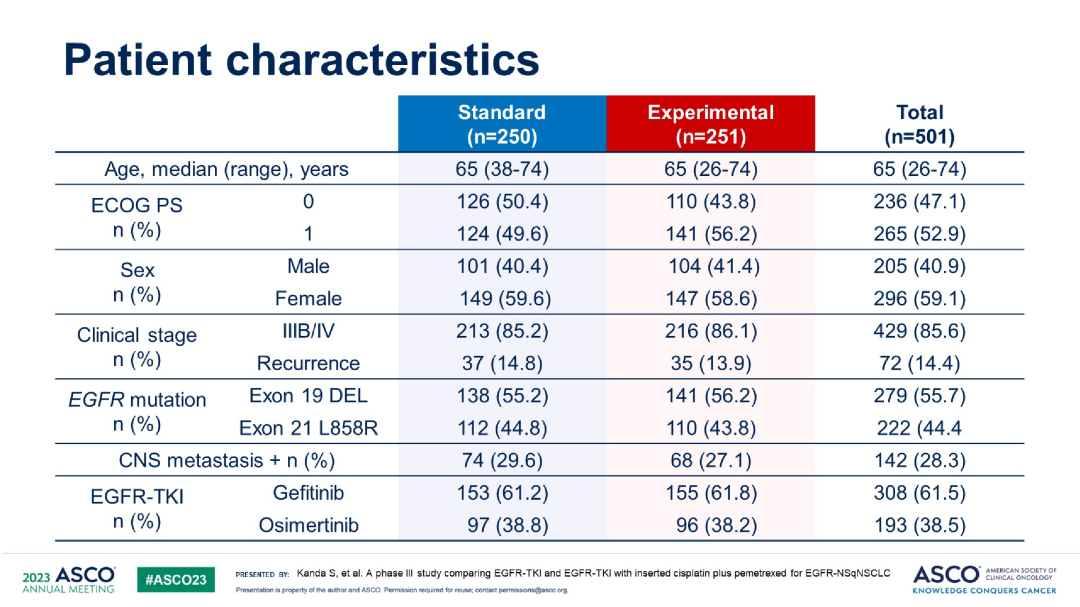
基线特征
结果显示,联合化疗组和单药靶向组的中位无进展生存期(PFS)分别为18.0 vs 12.0个月(HR 0.762,P=0.0058)。亚组分析显示,不同特征人群中,联合化疗组都展现出PFS获益。不过,在吉非替尼治疗的队列中,联合化疗的PFS获益更为显著(14.4 vs 9.6个月,HR0.687,P=0.0015);而在奥希替尼治疗队列中,并未观察到联合化疗能够在统计学上显著延长PFS(25.2 vs 20.4个月,HR 0.812,P=0.2475)。
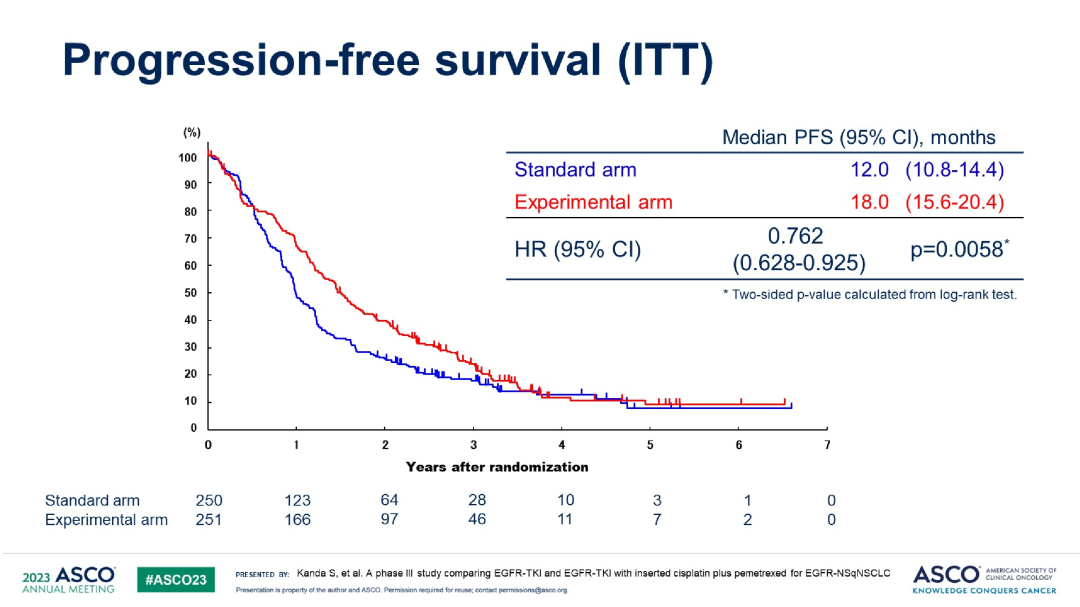
PFS
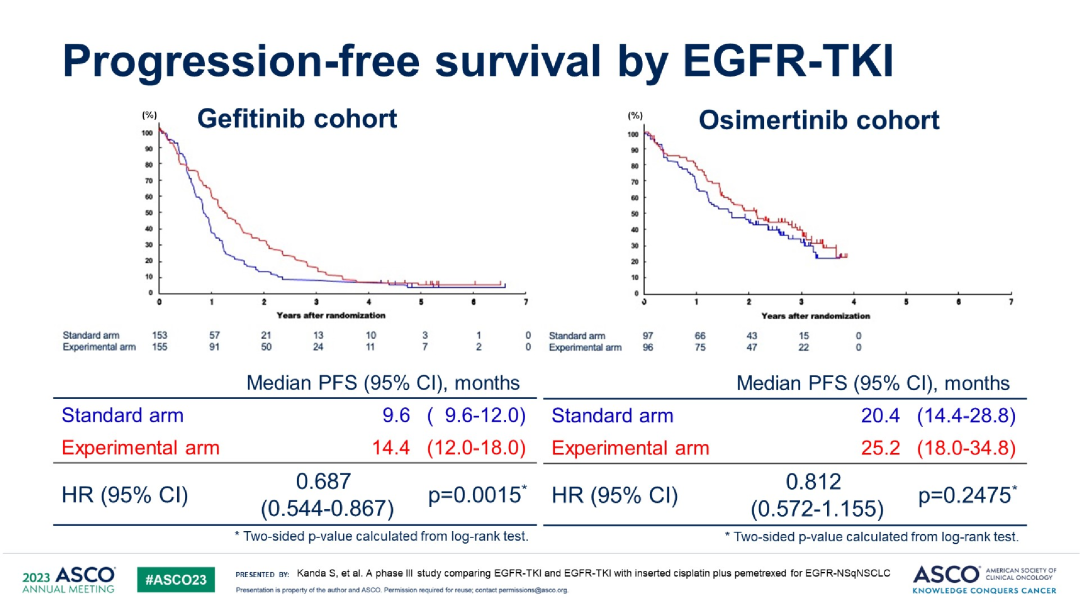
按不同靶向药分组的PFS在总生存(OS)结果方面,联合化疗组与单药靶向组的中位OS相似(48.0 vs 48.0个月,HR 0.985,P=0.4496)。以吉非替尼、奥希替尼为亚组进行分析,同样未观察到联合化疗对比单药治疗的OS差异。两组的客观缓解率(ORR)为78.0% vs 71.6%。
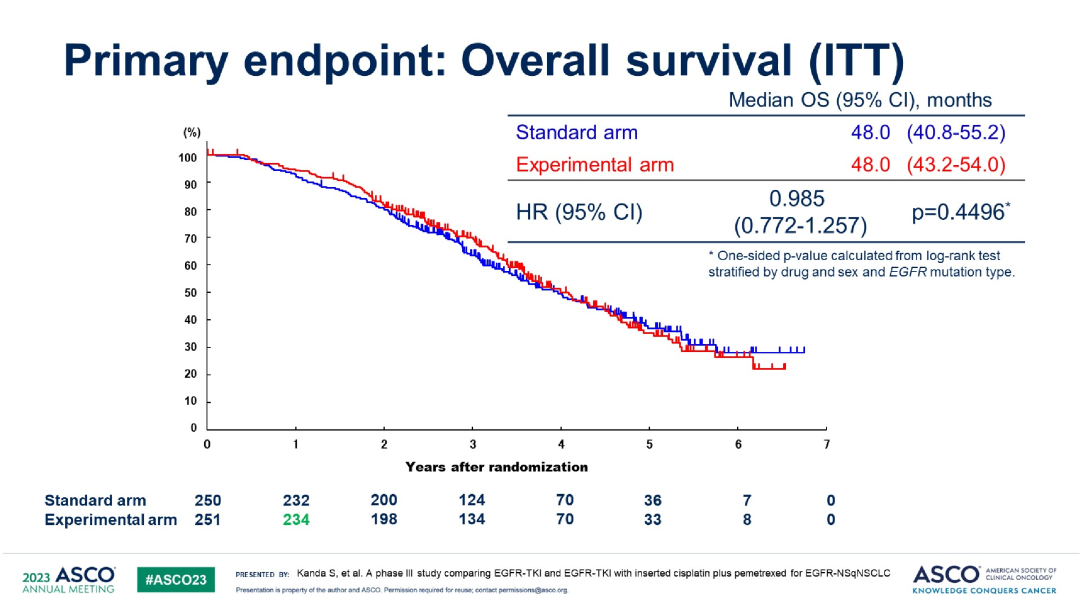
OS

按不同靶向药分组的OS
安全性方面,联合化疗组不良反应发生率高于单药靶向组。
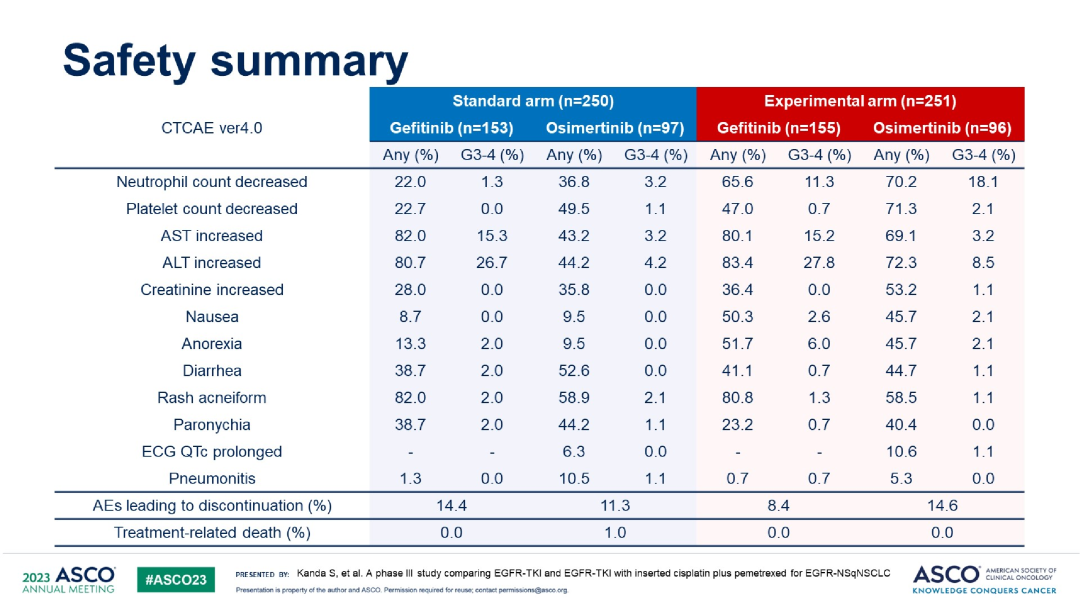
小结:在EGFR敏感突变非鳞状晚期NSCLC患者中,与标准疗法相比,加入含铂双药化疗并不能延长初始EGFR TKI应答患者OS,但可延长患者PFS。这个研究宣布靶向,加上化疗,继续靶向维持模式的失败,结合FLAURA 2的阳性结果【结果暂未公布】,是否说明化疗的持续应用是关键呢?另外,原本可以单用口服第三代TKI,患者生活质量高、甚至可以重新回到工作岗位,现在需要将患者拉回到医院重新接受静脉化疗,需要OS获益多大才能被接受呢?
靶向耐药治疗
SYMPHONY研究
肺癌(奥希替尼耐药)继发C797S突变,后续治疗
SYMPHONY研究:BLU-945是Blueprint Medicines公司研发的针对 EGFR敏感突变(19del或L858R)、T790M突变以及C797S突变(EGFR+/T790M/C797S)和 EGFR+/T790M突变的有效且高度选择性的抑制剂,在PDX模型中显示了体内抗肿瘤活性。基于此,研究者启动了 SYMPHONY(NCT04862780)研究,是一项针对转移性 EGFRm NSCLC患者的1/2期研究,以确定最大耐受剂量和/或2期推荐剂量(RP2D);并评估BLU-945的安全性、药代动力学(PK)和抗肿瘤活性。
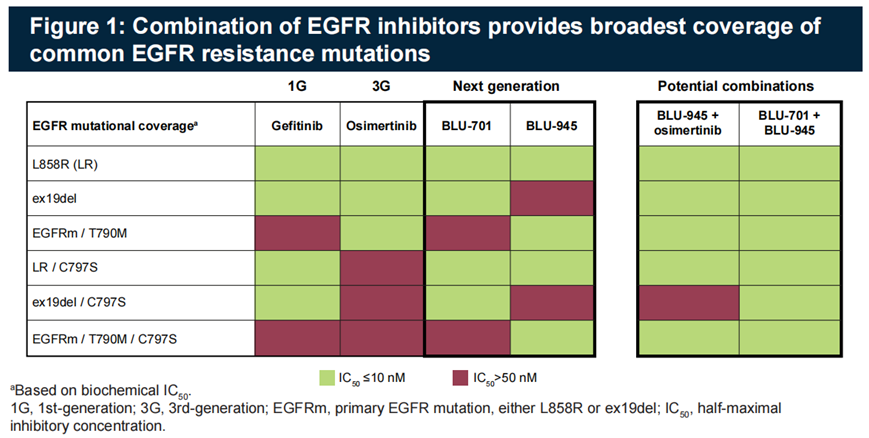

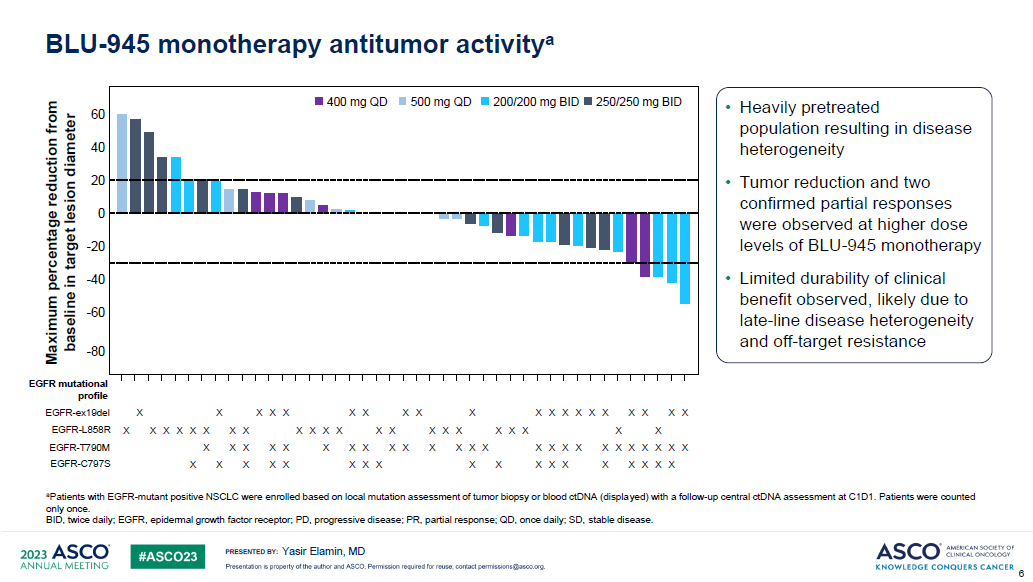
研究结果:BLU-945单药组,纳入112例三代EGFR-TKI耐药的晚期NSCLC患者,剂量范围25–600 mg qd或100–300 mg bid。大部分治疗相关不良反应为1-2级,有12例患者在每日400-600mg时出现剂量限制毒性,最常见的为3级ALT和AST升高。有2例患者死于不良反应,1例为肺炎(BLU-945 300mg bid),1例为颅内出血(BLU-945 100mg bid)。
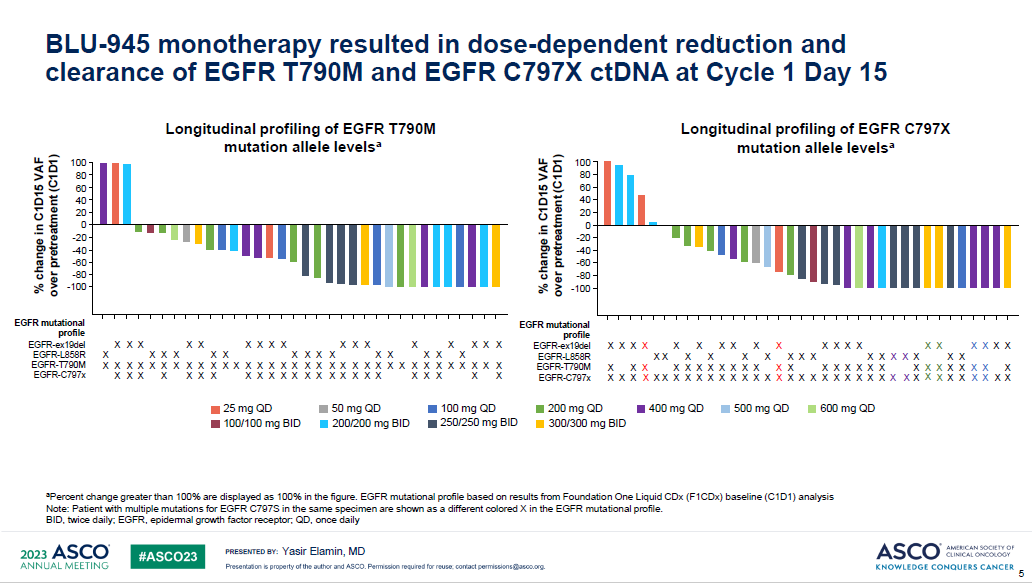
第15天的ctDNA检测结果显示,绝大多数患者的T790M和C797X突变丰度下降。其中4例患者部分缓解,剂量分别为200mg bid 3例,400mgqd1例。
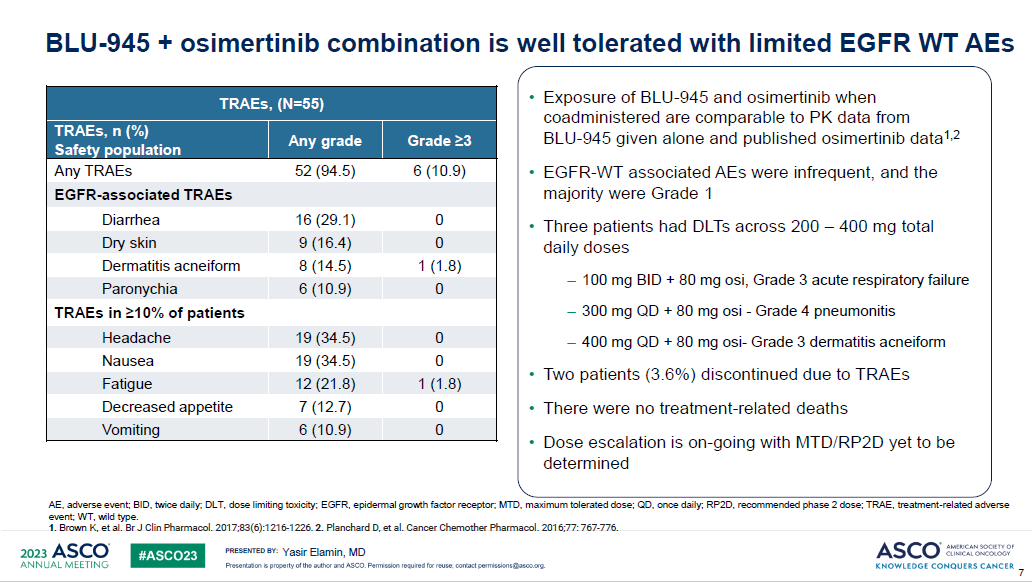
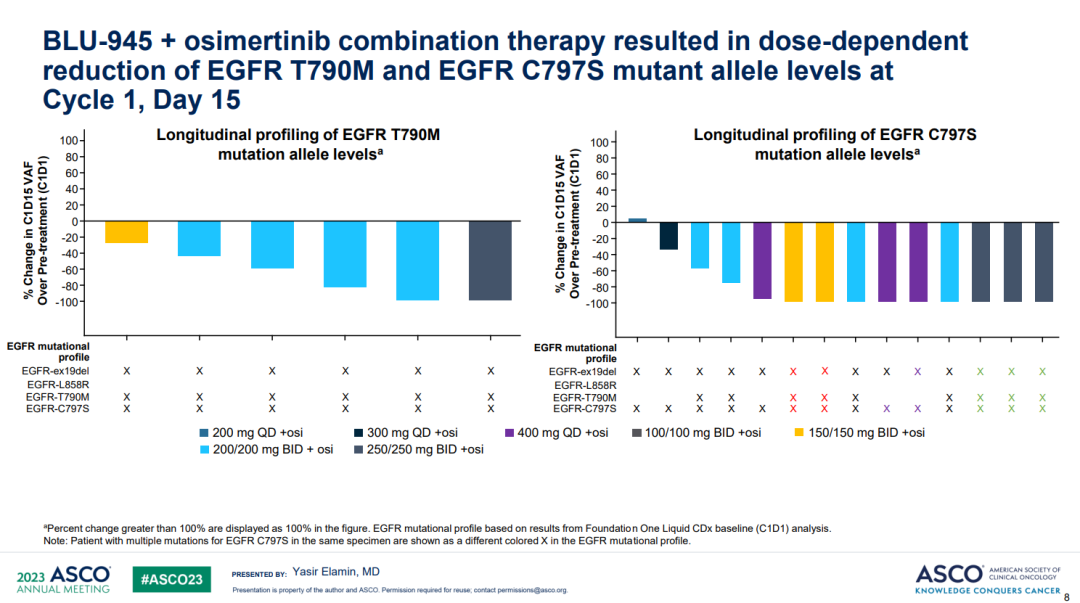
BLU-945+奥希替尼组,纳入55例三代EGFR-TKI耐药的晚期NSCLC患者,剂量范围200–400 mg qd或100–200 mg bid。≥3级的治疗相关不良反应为10.9%,EGFR靶向相关副作用主要是腹泻、皮肤干燥、痤疮样皮肤炎和甲沟炎,多为1级。3例患者发生剂量限制毒性,3级急性呼吸衰竭、4级肺炎、3级皮疹各1例。没有治疗相关性死亡病例。2期推荐剂量(RP2D)仍未确定。

第15天的ctDNA检测结果显示,绝大多数患者的T790M和C797X突变丰度下降。其中9例患者部分缓解,剂量如下图所示。
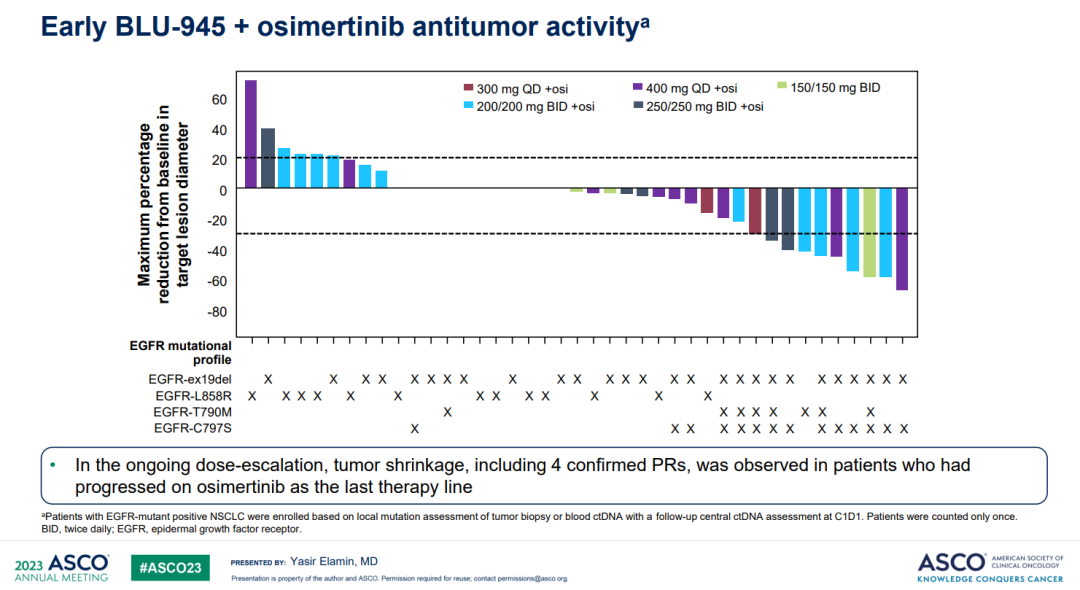
小结:在多线治疗后的EGFR突变NSCLC患者中,BLU-954治疗展现出一定的疗效,安全性可耐受,然而疗效有待提高。
CHRYSALIS-2研究
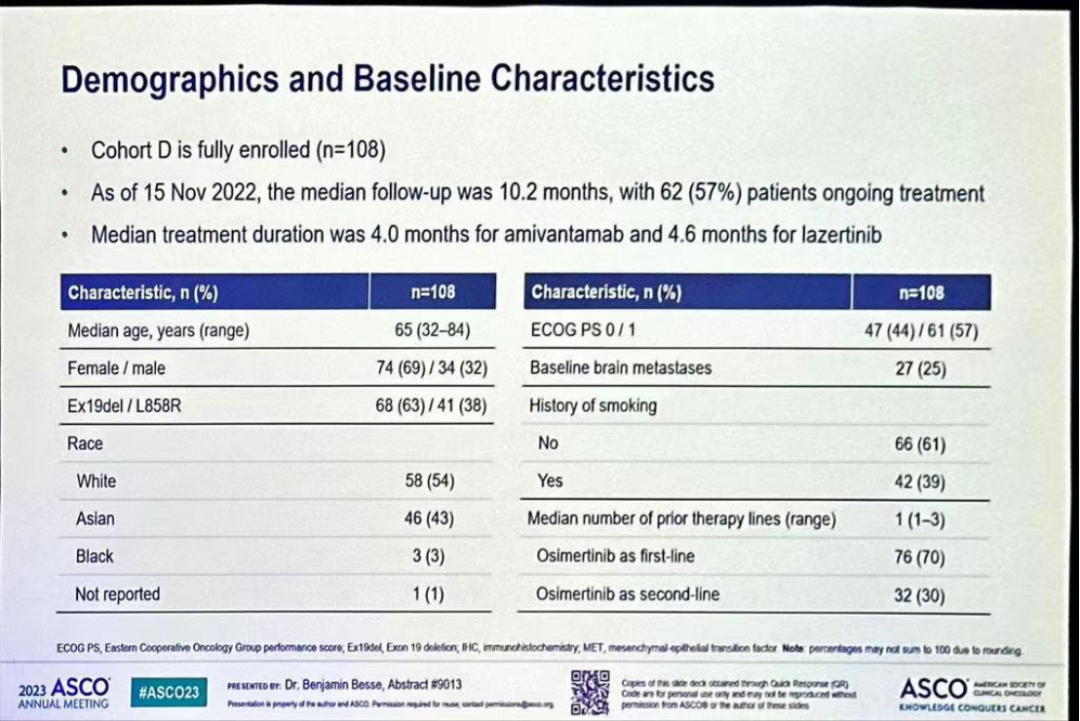
CHRYSALIS-2研究:是一项正在进行的I/Ib期研究,评估Amivantamab+lazertinib对EGFR NSCLC患者的疗效。D队列纳入108例奥希替尼耐药且未经化疗的EGFR突变晚期患者接受Amivantamab+Lazertinib治疗,本次会议公布了生物标志物研究结果。

研究结果:87例患者具有可检测的基线ctDNA,77名患者具有可评估的MET IHC。训练集(n=50)确定了基于IHC在≥25%肿瘤细胞中染色为3+(MET+)可以作为潜在的生物标志物,验证集(n=27)证实了该结果。研究共有28例为MET+,MET+患者总ORR率为61%(95%CI,41-78),中位PFS为12.2个月;而MET-患者总ORR率为12%,中位PFS为4.1个月。
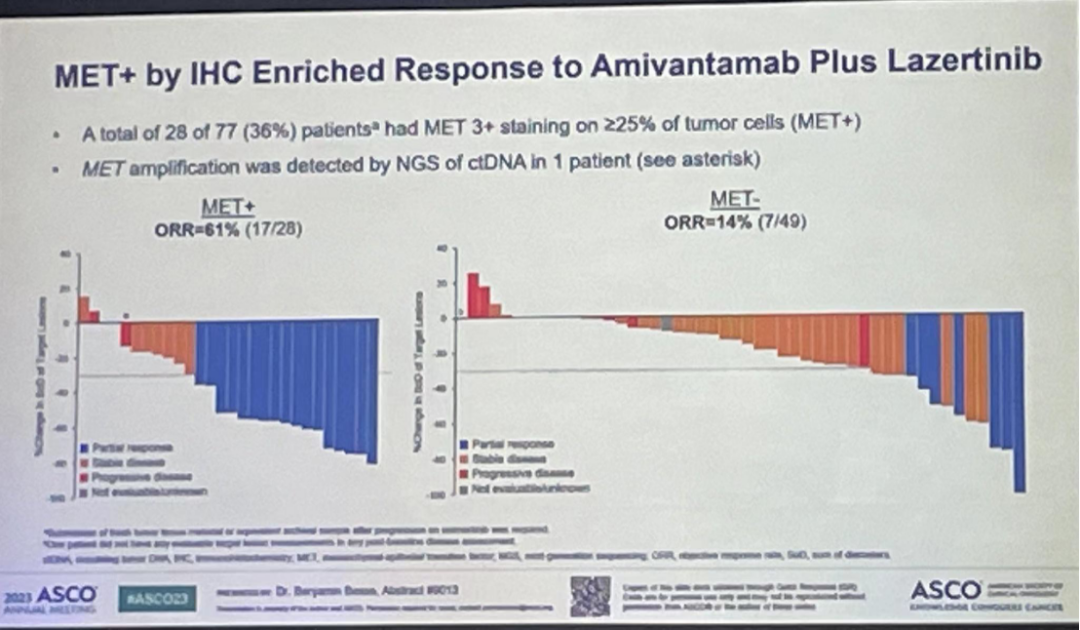
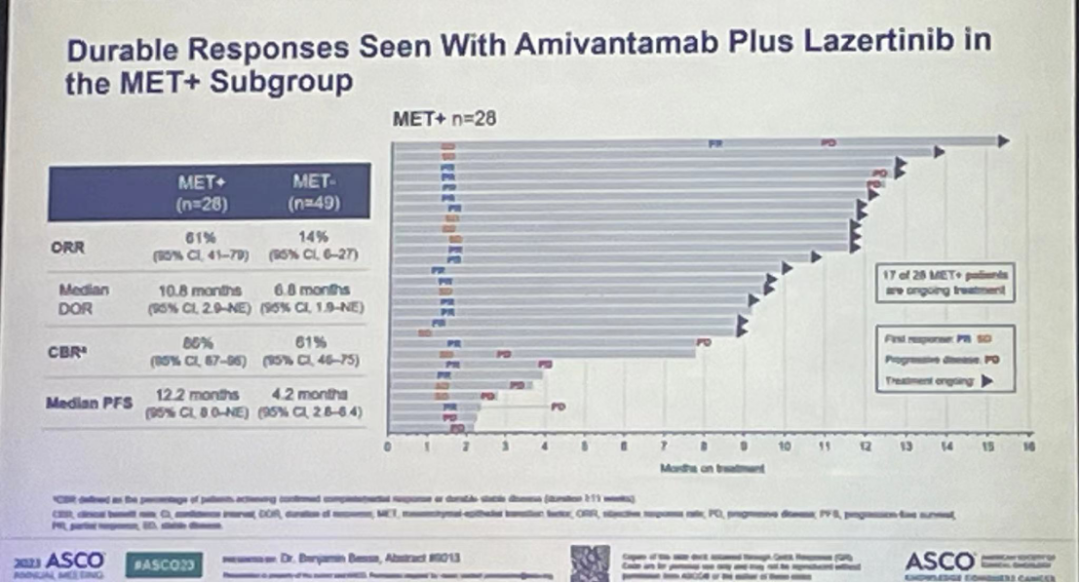
值得注意的是,ctDNA NGS评估没有发现符合预先设置的预测性生物标志物标准。只有1例患者的ctDNA结果为MET扩增(同时IHC也为MET+)。

EGFR靶向耐药,单抗和ADC药物疗效
EGFR 20ins免费新药丨DZD9008治疗EGFR 20号外显子插入突变的局部进展或转移性非小细胞肺癌WU-KONG1、15研究
舒沃替尼(DZD9008)是一款口服、不可逆的、针对多种EGFR突变亚型的、高选择性EGFR抑制剂。舒沃替尼针对经治的EGFR exon20ins突变型NSCLC的两项关键性研究正在进行中【包括全球II期关键研究“悟空1 B部分”(WU-KONG1 Part B ,NCT03974022)和中国II期关键研究“悟空6”(WU-KONG6,NCT05712902)】;WU-KONG6初步结果显示,舒沃替尼具有良好的疗效和安全性。此外,针对初治EGFR exon20ins突变患者的两项研究也在进行中【“悟空1 A部分”(WU-KONG1 Part A)和“悟空15”(WU-KONG15,NCT05559645)】,本文首次报道了舒沃替尼对该人群的初步疗效分析结果。
WU-KONG1是一项全球多中心I/II期研究,WU-KONG15是一项中国研究者发起的II期研究,两项研究均纳入了初治的EGFR exon20ins突变型晚期NSCLC患者。入组患者接受舒沃替尼单药口服治疗(剂量:200mg QD或者300mg QD)。
研究结果:截至2023年2月21日,共28例初治的EGFR exon20ins突变患者纳入疗效分析集,超过12种突变亚型。舒沃替尼单药一线治疗EGFR exon20ins突变患者,在RP2D剂量(300mg QD)下的最佳客观缓解率(ORR)达77.8%。
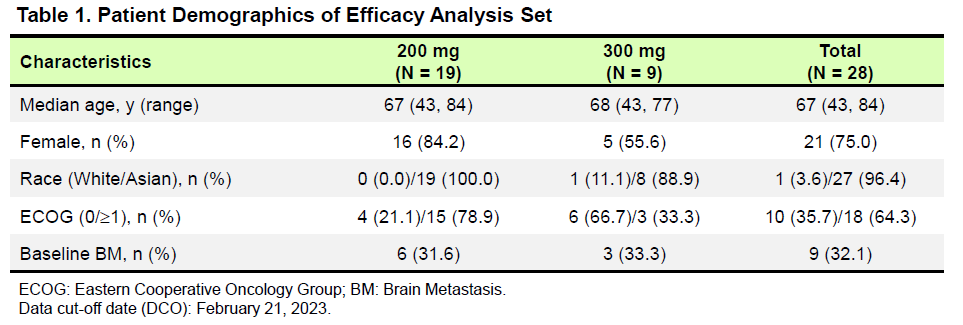
汇总分析的基线特征
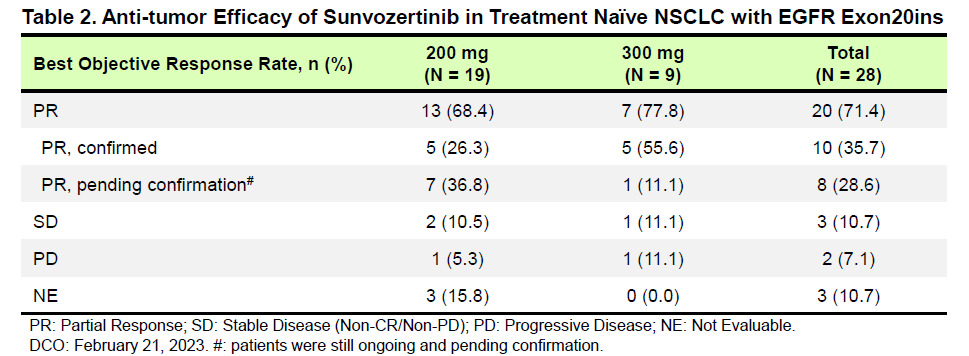
临床疗效至数据截止日期,最长治疗持续时间>9.8个月,超过80%的肿瘤缓解患者仍处于持续缓解中,中位 DoR仍未达到。
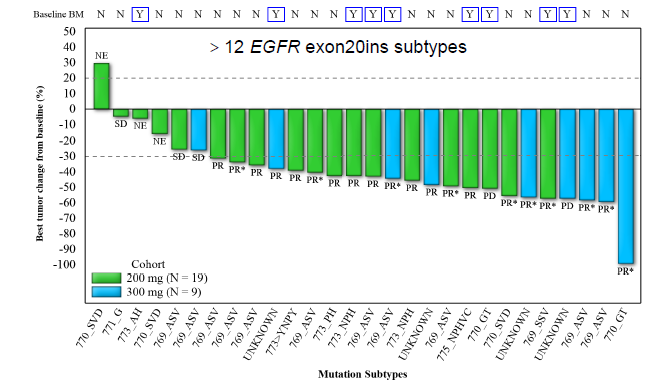
靶病灶最佳缓解情况
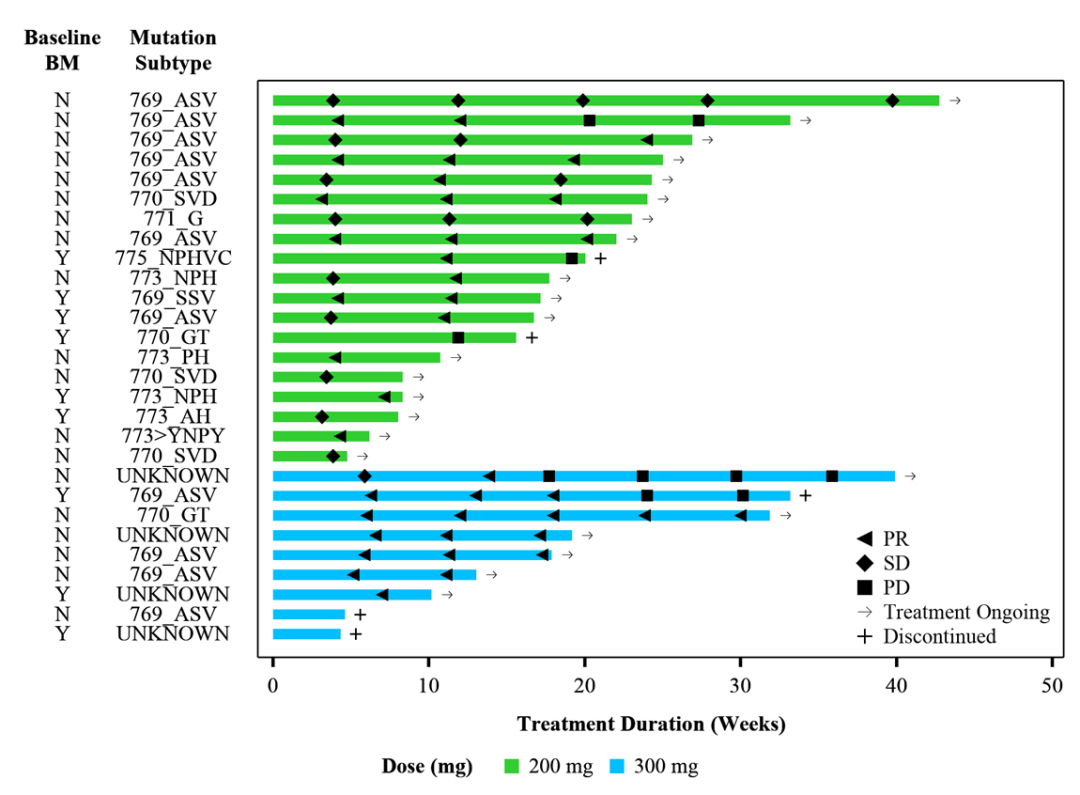
治疗持续时间
安全性:舒沃替尼一线治疗耐受性良好,安全性和既往二/后线报道一致,大多数治疗期间不良事件 (TEAEs) 为 CTCAE 1-2 级,临床可管理可恢复。最常见的≥3级TEAEs包括CPK升高 (14.3%)、腹泻 (3.6%)、脂肪酶升高 (3.6%) 和皮疹 (3.6%),没有患者因药物相关性TEAEs终止治疗。小结:舒沃替尼单药一线治疗EGFR exon20ins突变型晚期NSCLC展现出令人鼓舞的疗效和良好的耐受性,且无论EGFR exon20ins突变亚型或插入位置,舒沃替尼均展示了良好的抗肿瘤活性。目前,一项舒沃替尼一线治疗EGFR exon20ins突变型NSCLC的III期、随机、全球多中心临床研究WU-KONG28(NCT05668988)正在进行中。
非小细胞肺癌-靶向治疗部分
围术期免疫治疗
KEYNOTE-671研究
KEYNOTE-671研究[3]:是一项随机、双盲、 3期试验, 旨在评估帕博利珠单抗联合化疗新辅助治疗用于可切除的 Ⅱ、ⅢA、ⅢB 期非小细胞肺癌患者,并在术后接受帕博利珠单抗单药辅助治疗的疗效与安全性。可手术切除的Ⅱ、ⅢA、ⅢB期(N2期)NSCLC参与者以1:1比例分配接受帕博利珠单抗(200 mg)或安慰剂新辅助治疗,每3周一次,两组均联用4个周期以顺铂为基础的化疗,随后进行手术;再接受帕博利珠单抗(200 mg)或安慰剂辅助治疗,每3周一次,最多13个周期。研究分层因素包括PD-L1表达水平、病理学类型和肿瘤疾病分期。研究主要终点是无事件生存期(EFS)和总生存期(OS);关键次要终点为病理学完全缓解率(pCR)、主要病理学缓解率(mPR)。
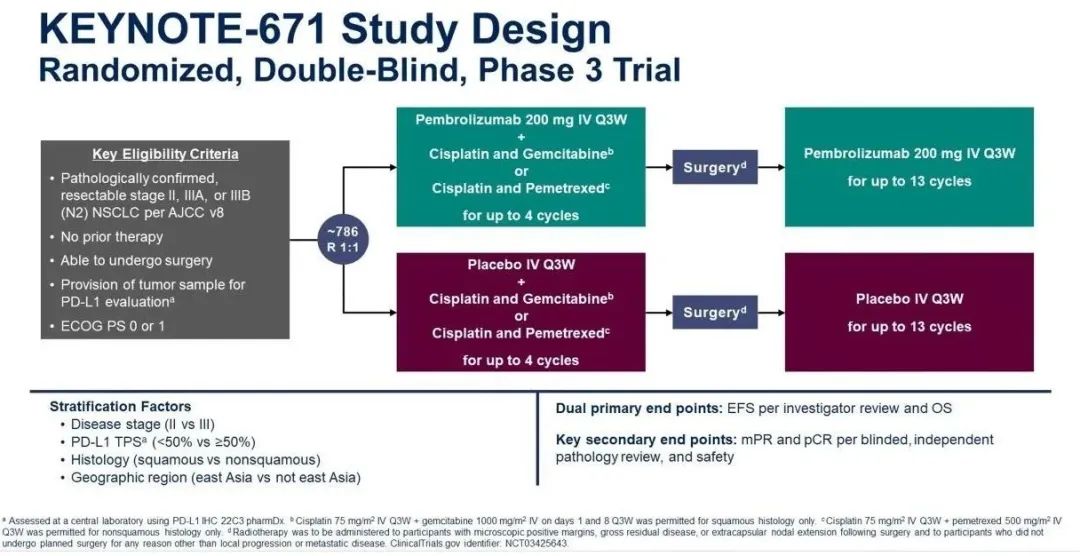
研究设计
研究结果:共计397名参与者被分配至帕博利珠单抗组,400名参与者被分配至安慰剂组。在预设的第一次期中分析时,中位随访期为25.2个月。帕博利珠单抗组的24个月无事件生存率为62.4%,安慰剂组为40.6%(HR=0.58;95%CI,0.46~0.72;P<0.001)。帕博利珠单抗组的估计24个月总生存率为80.9%,安慰剂组为77.6%(P=0.02,不符合显著性标准)。后续将继续随访OS数据。
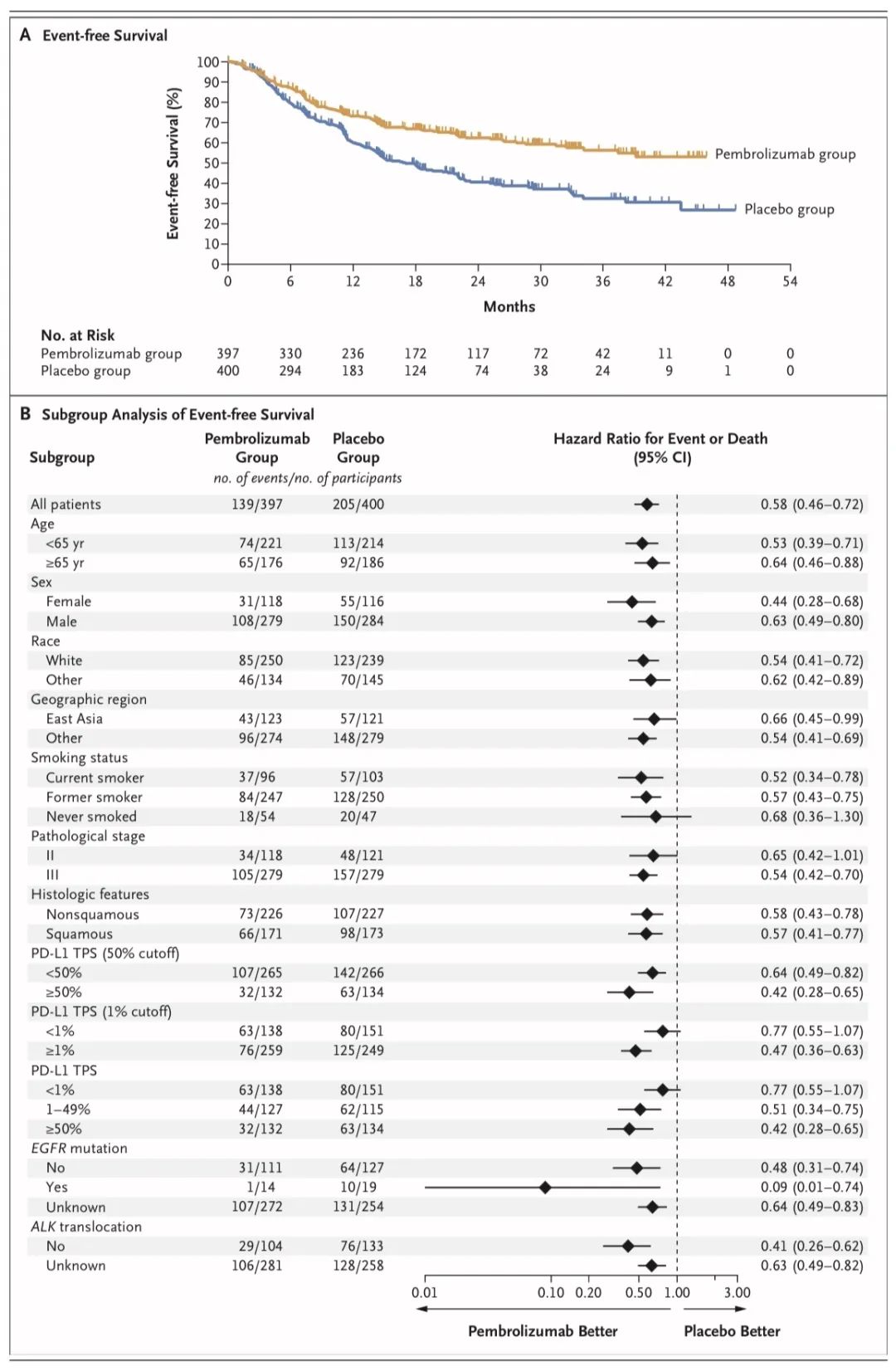
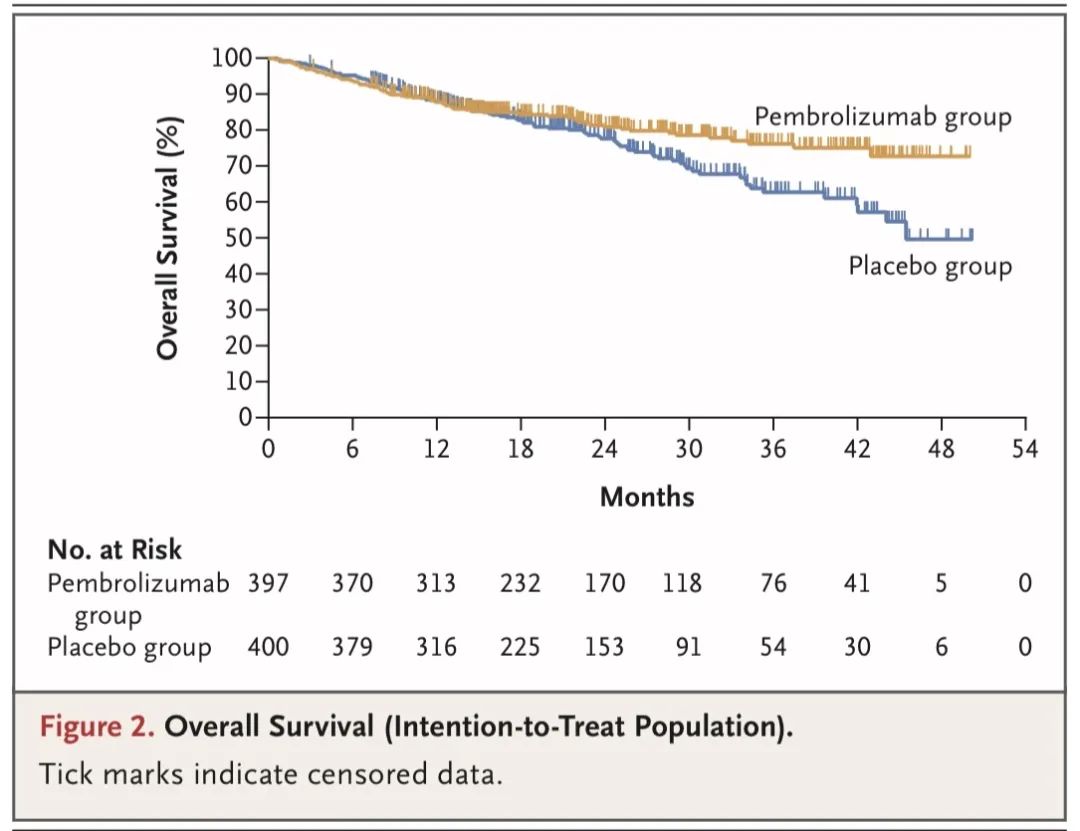
↑ 总生存率
← 无事件生存率
帕博利珠单抗组的主要病理学缓解率为30.2%,安慰剂组为11.0%(95% CI,13.9~24.7;P<0.0001;阈值,P=0.0001),两组病理学完全缓解率分别为18.1%和4.0%(95% CI,10.1~18.7;P<0.0001;阈值,P=0.0001)。探索性分析结果显示,无论患者是否有MPR或pCR,帕博利珠单抗治疗都会给无事件生存带来好处。
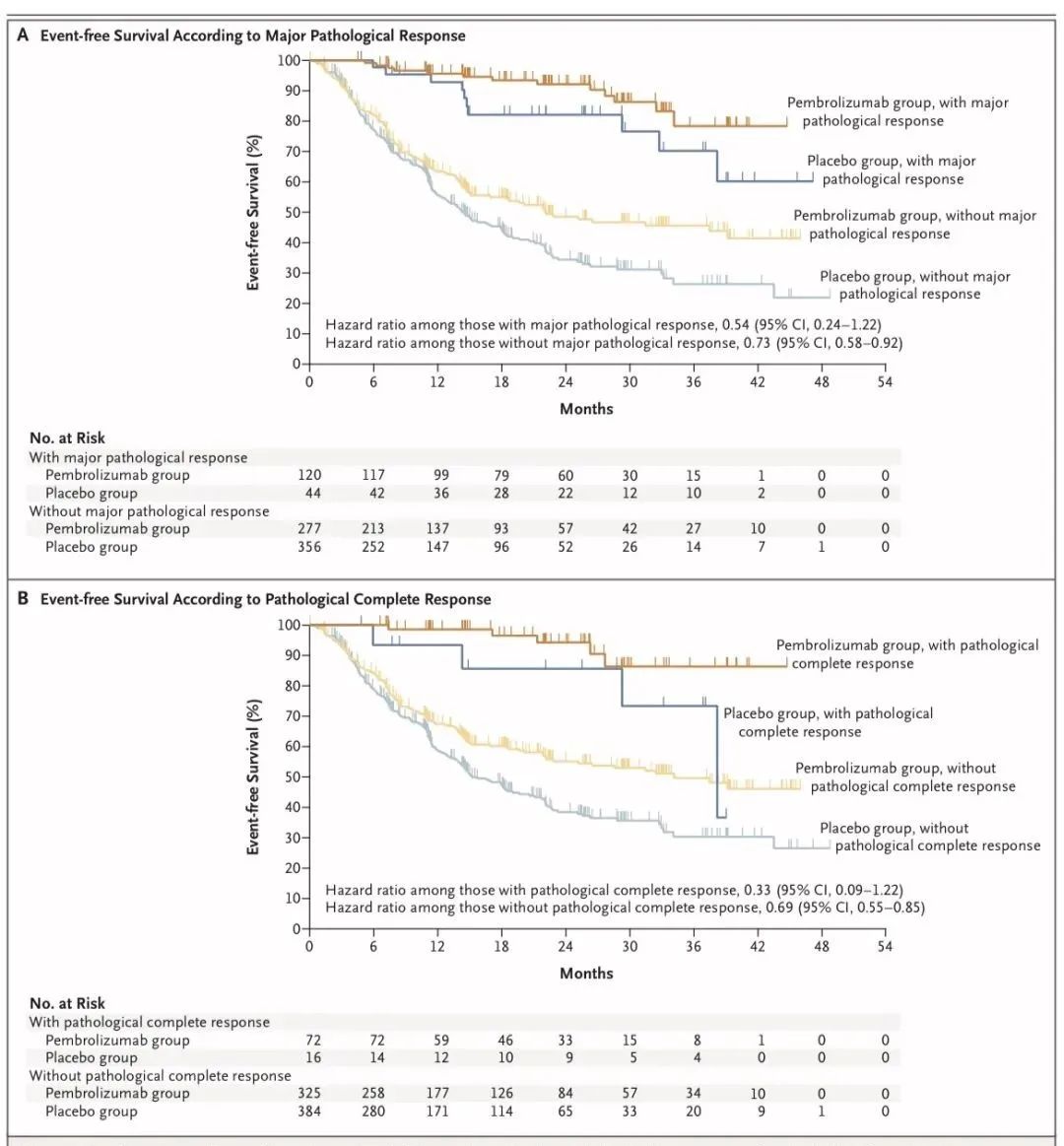
探索性分析
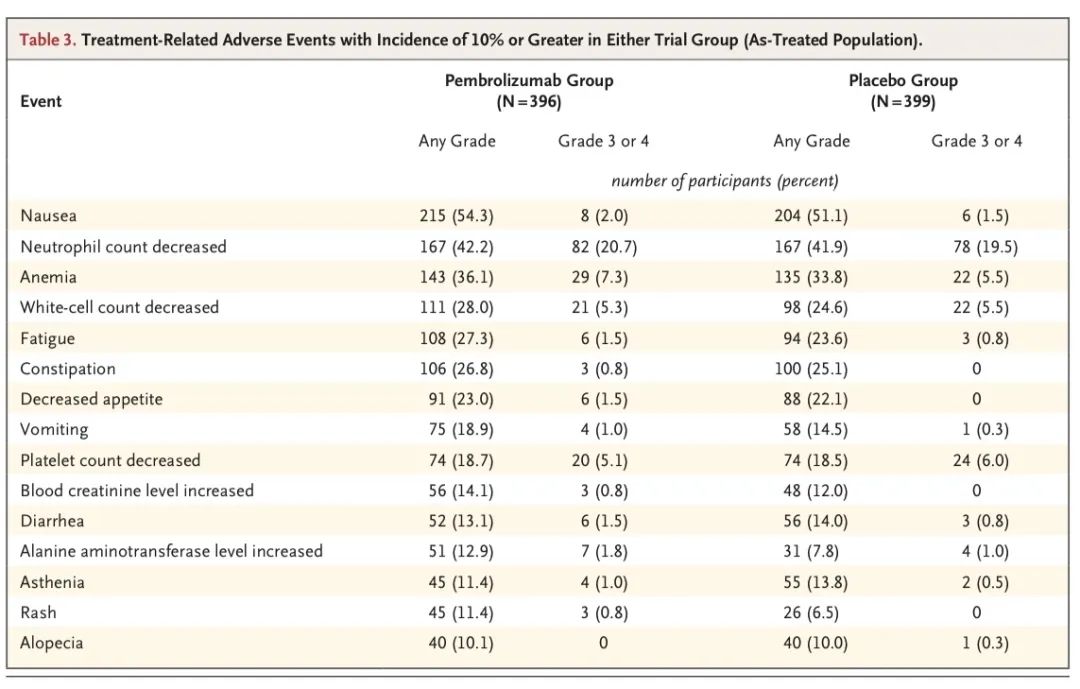
不良反应
安全性:在所有治疗阶段,帕博利珠单抗组和安慰剂组分别有44.9%和37.3%的参与者发生了≥3级治疗相关不良事件,分别有1.0%和0.8%的参与者发生了5级事件。在整个治疗期间,有7名患者因治疗相关的不良事件死亡,其中帕博利珠单抗组有4名(在新辅助-手术阶段,各有1人死于免疫介导的肺部疾病、肺炎和心脏猝死;在辅助治疗阶段1人因心房颤动死亡),安慰剂组3名(在新辅助治疗-手术阶段,急性冠状动脉综合征、肺炎和肺出血各导致1人死亡)。
小结:在可手术切除的早期NSCLC患者中,与单纯新辅助化疗后进行手术相比,新辅助帕博利珠单抗联合化疗后进行手术切除、手术后接受帕博利珠单抗辅助治疗显著改善无事件生存期、主要病理学缓解率和病理学完全缓解率。在此次分析时,两组总生存并无显著差异。Neotorch研究
Neotorch研究:是一项随机、双盲、安慰剂对照的III期临床研究,旨在比较特瑞普利单抗或安慰剂联合化疗用于II/III期可手术NSCLC患者围手术期治疗的疗效和安全性。研究计划纳入II-III期NSCLC患者500名,以1:1的比例随机接受特瑞普利单抗或安慰剂联合化疗术前3周期及术后1周期治疗(鳞癌患者化疗方案为紫杉类+铂类,非鳞癌患者化疗方案为培美曲塞+铂类),随后接受特瑞普利单抗或安慰剂巩固治疗13周期。研究按照疾病分期、拟手术方式、组织学分型、肿瘤PD-L1表达情况进行分层。主要终点为研究者评估的III期及II-III期患者的EFS、BIPR评估的III期及II-III期患者的MPR。次要终点包括OS、pCR、独立评审委员会(IRC)评估的EFS、无病生存期(DFS)和安全性等。
左右滑动查看更多
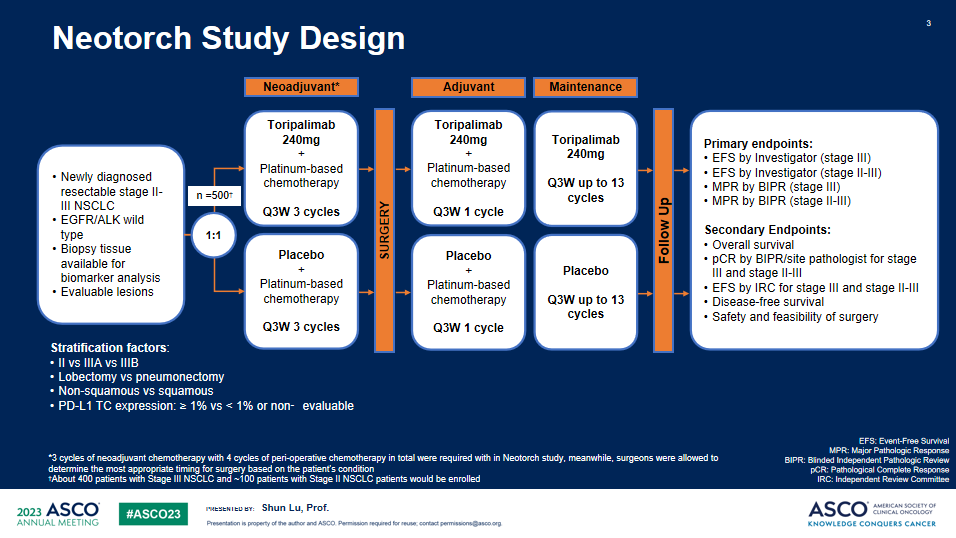
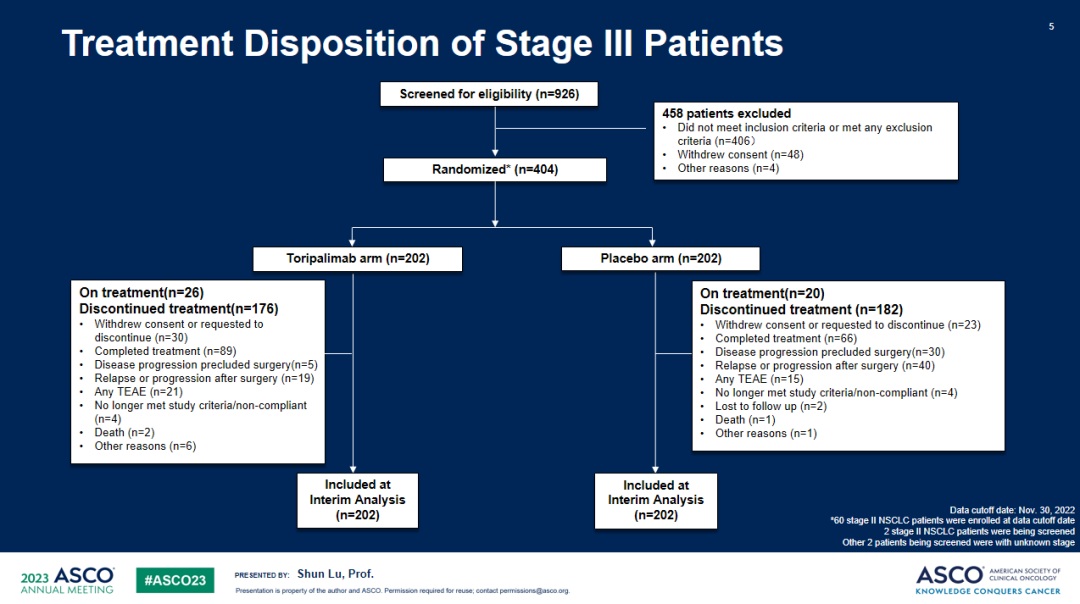
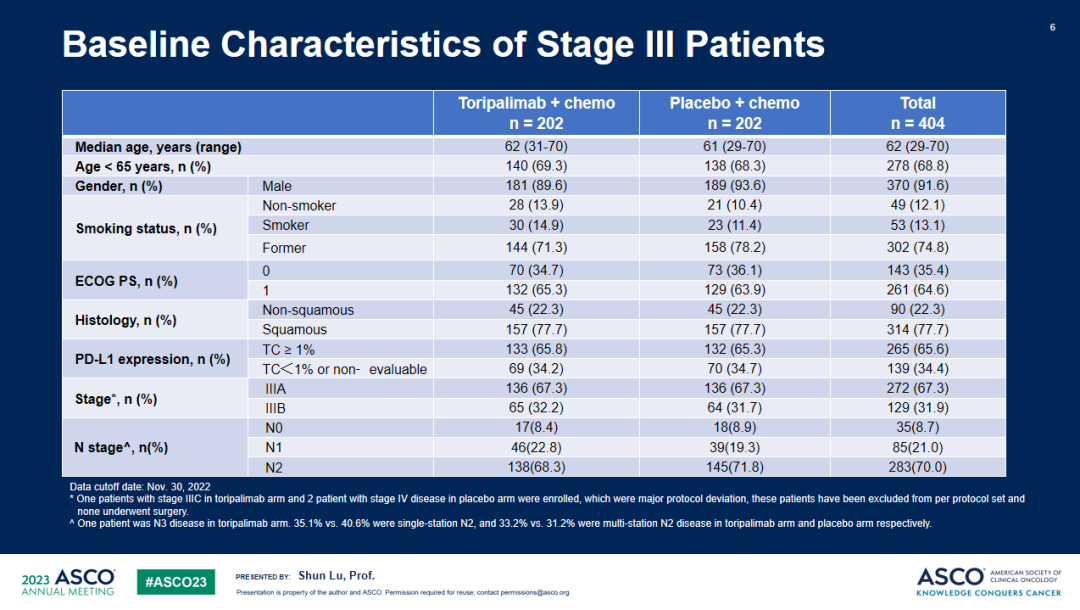
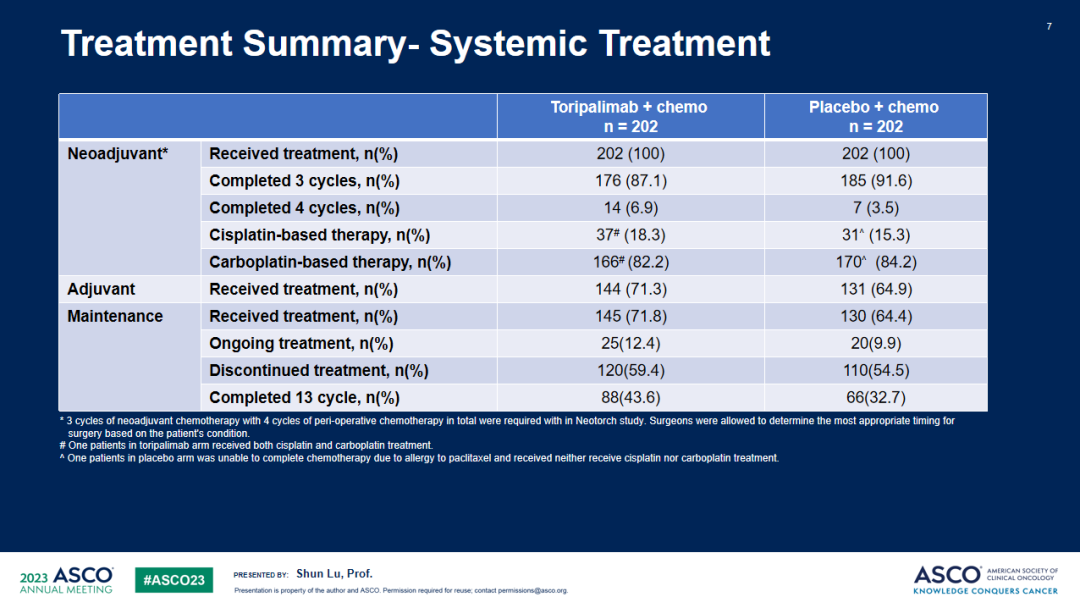
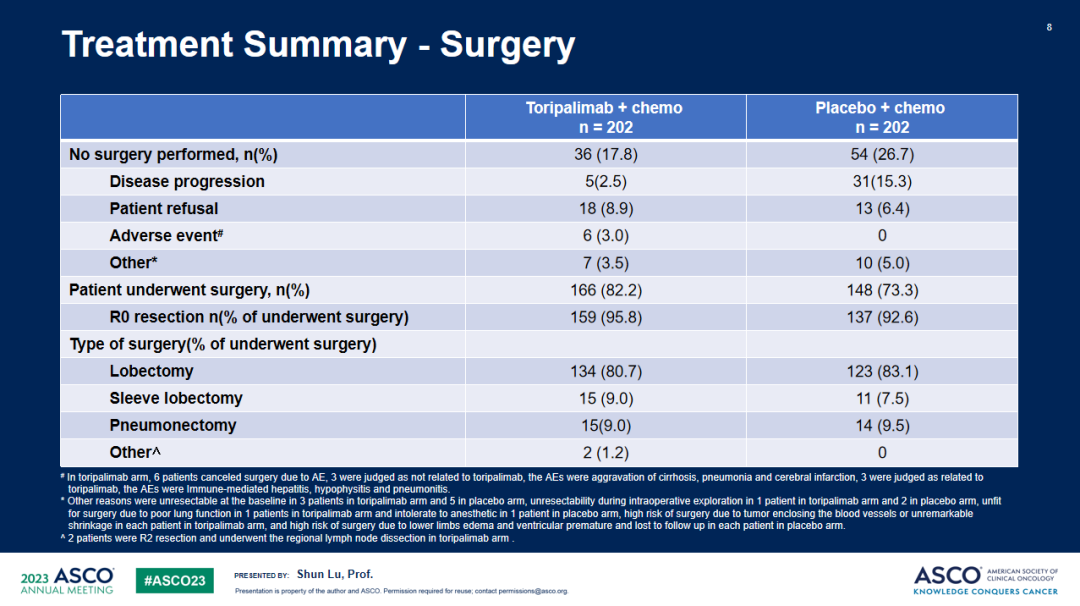
研究结果:共纳入404例III期NSCLC患者,被随机分配至特瑞普利单抗联合化疗组(n=202)或安慰剂联合化疗组(n=202),两组受试者基线特征均衡。截至2022年11月30日,共观察到144例研究者评估的EFS事件数,中位随访18.25个月。
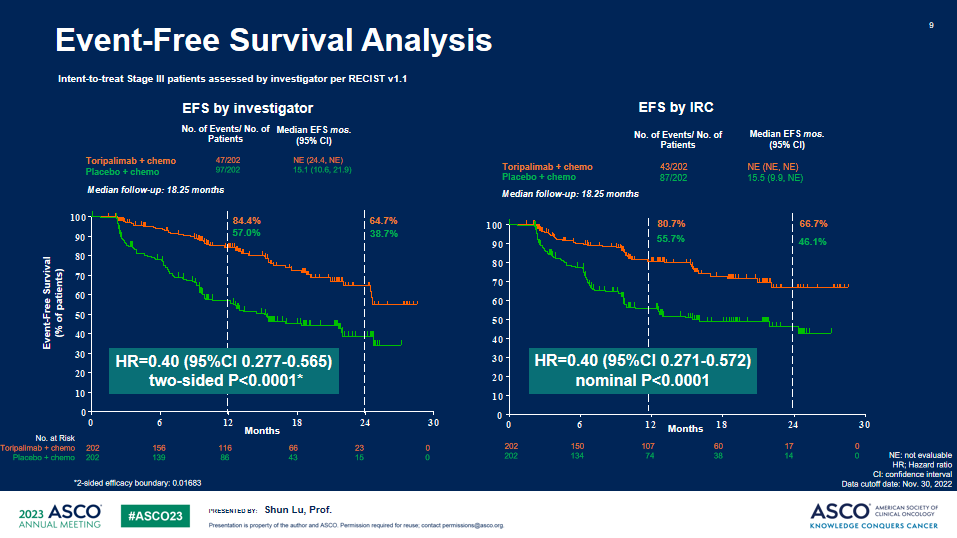
EFS
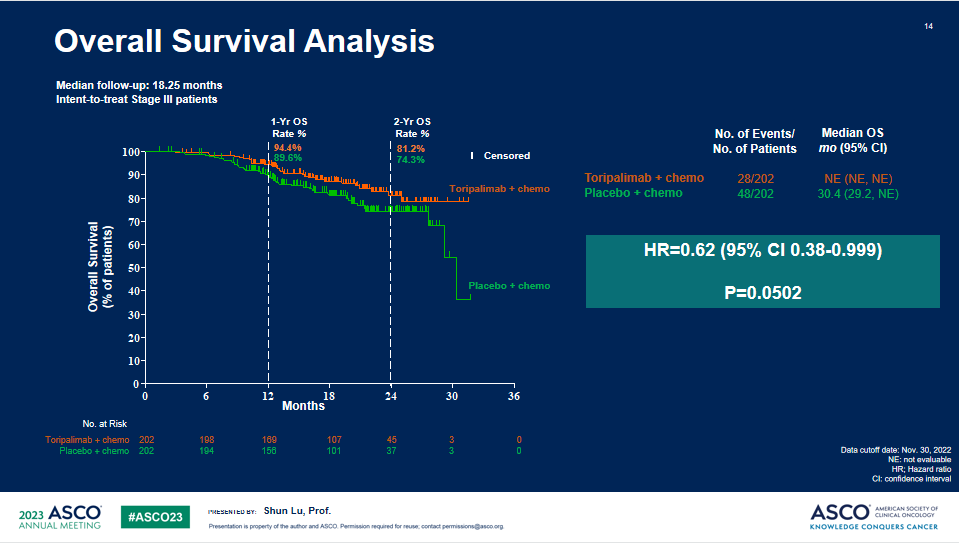
OS
a. 与安慰剂联合化疗相比,特瑞普利单抗联合化疗组EFS显著延长,中位EFS分别为 尚未成熟 vs 15.1个月 (HR=0.40;95%CI:0.277-0.565)。所有关键亚组中均观察到特瑞普利单抗联合化疗组的EFS获益。b. OS描述性分析显示,特瑞普利单抗联合化疗组有明显的OS获益趋势:两组中位OS分别为未成熟 vs 30.4个月, HR = 0.62(95% CI: 0.381-0.999)。
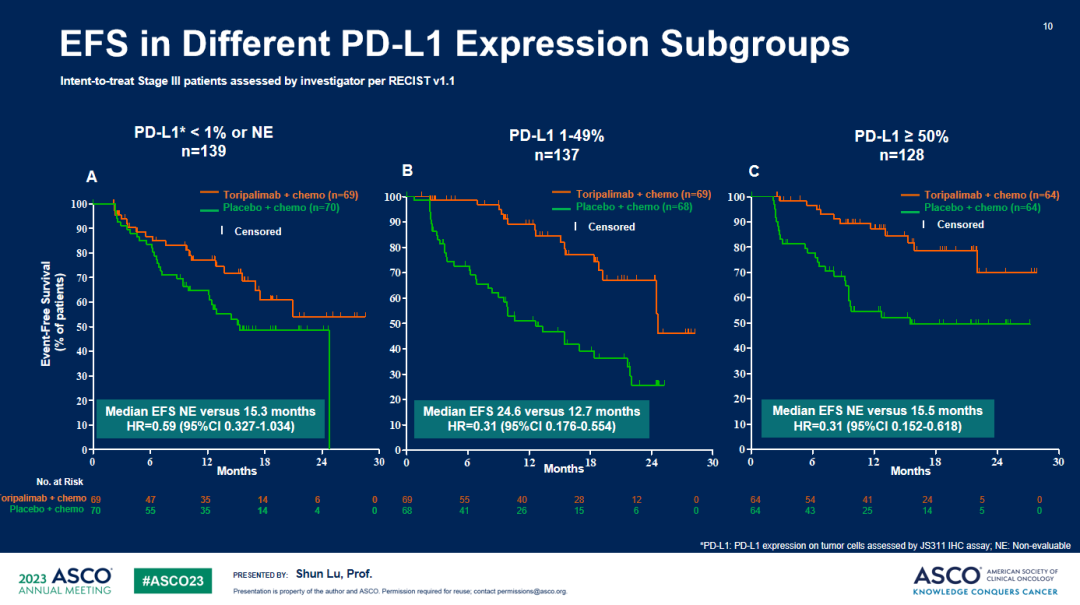
EFS亚组分析1
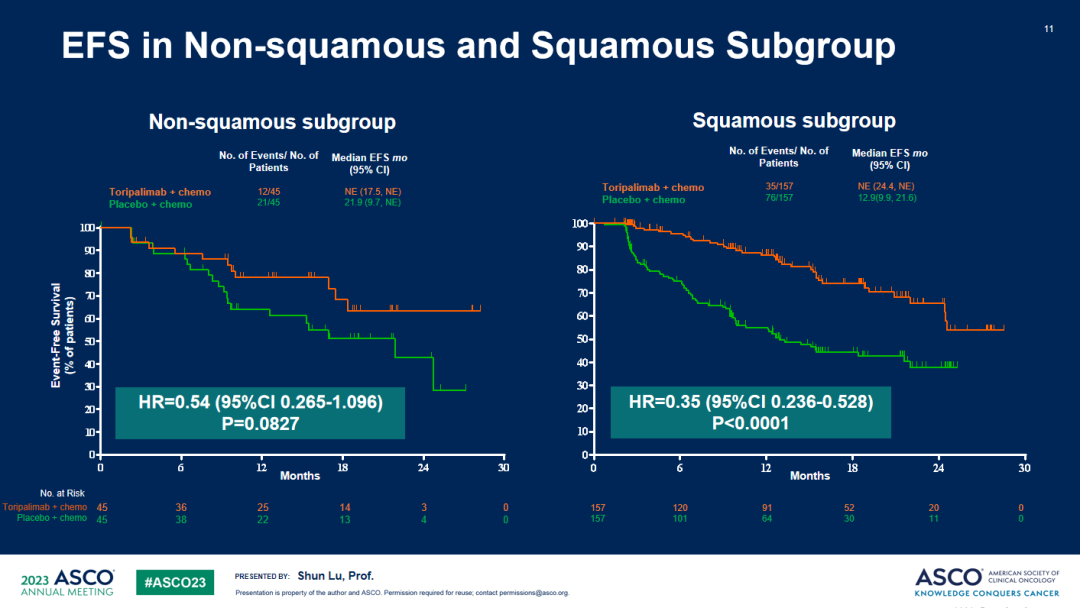
EFS亚组分析2
c. 特瑞普利单抗联合化疗组的MPR及pCR率均明显高于安慰剂联合化疗组,BIPR评估的MPR率分别为48.5% vs 8.4%(P<0.0001)、pCR率分别为24.8% vs 1.0%(P<0.0001)。
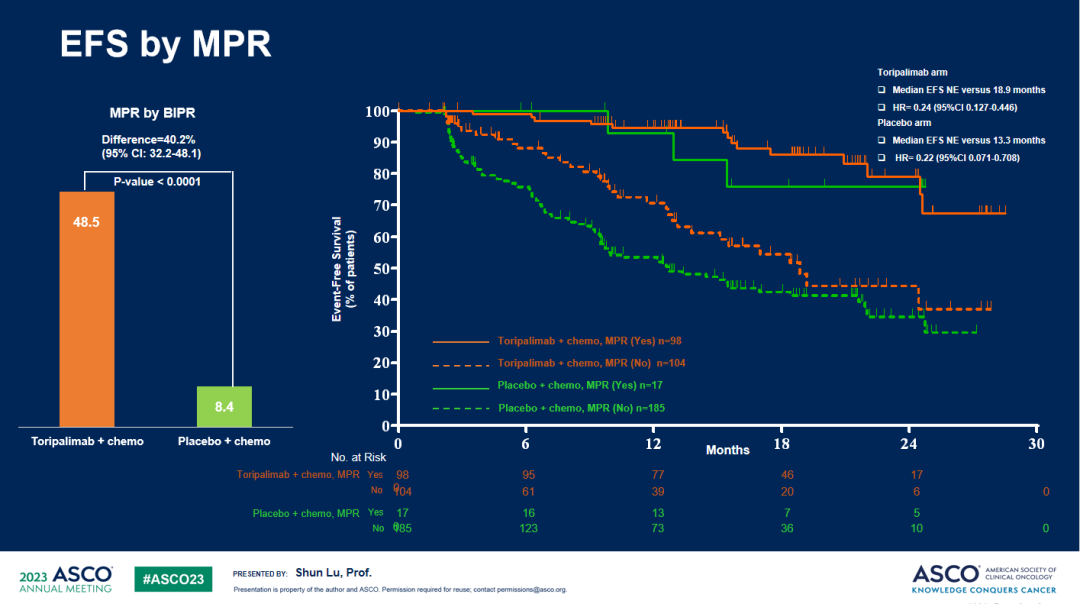
MPR
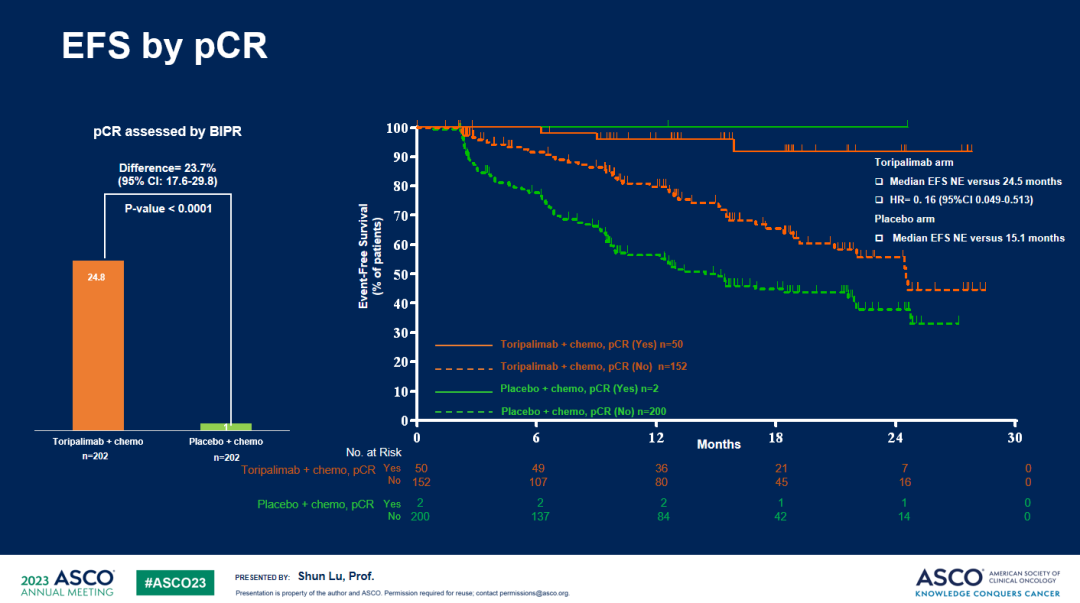
pCR
安全性方面,两组治疗期间出现的不良事件(TEAE)发生率相似,未发现新的安全性信号。与安慰剂联合化疗组相比,特瑞普利单抗联合化疗组发生≥3级AE(63.4% vs 54.0%)。
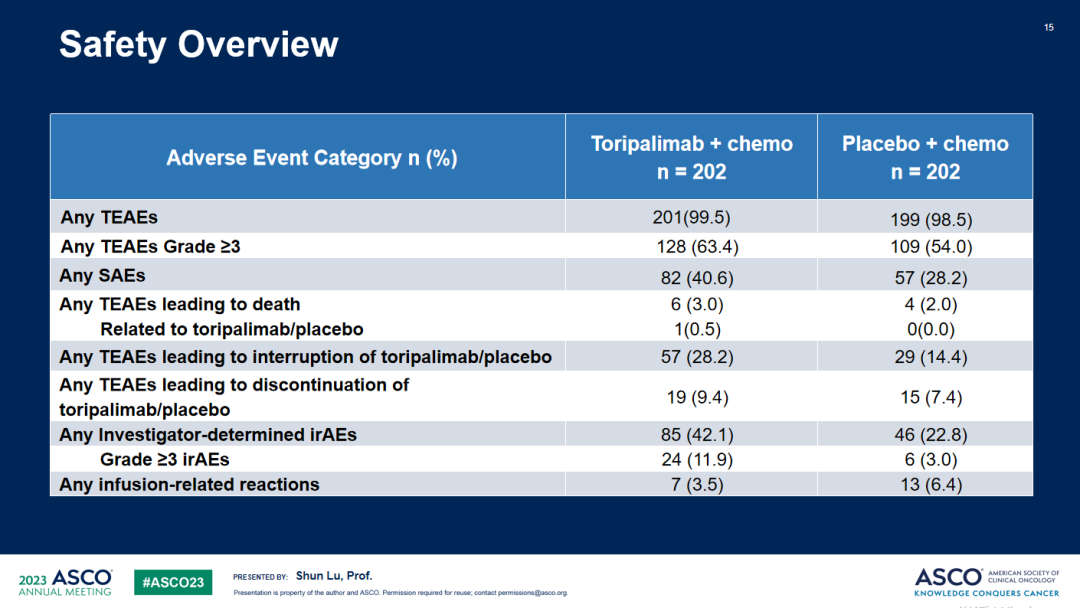
安全性
综上,与单纯化疗相比,特瑞普利单抗联合化疗围手术期治疗后特瑞普利单抗单药巩固治疗可显著改善III期NSCLC患者的EFS,提高MPR和pCR率,更多的患者可通过特瑞普利单抗联合治疗获得根治性手术的机会,且安全性可预期、可管理,未观察到新的安全性信号。患者将继续进行OS随访。
晚期免疫治疗
TROPION-Lung02研究
TROPION-Lung02研究[4]:是一项正在进行的全球性、开放性、六队列Ib期研究,旨在评价两种给药剂量(4 mg/kg和6 mg/kg)的Dato-DXd与帕博利珠单抗(200 mg)联合治疗伴或不伴四个周期的铂类化疗(卡铂或顺铂)在既往未经治疗或预治疗无AGA(例如:EGFR、ALK、ROS1、NTRK、BRAF、RET、MET或其他已知AGA)的晚期或转移性NSCLC患者中的安全性和疗效。TROPION-Lung02的主要终点是剂量限制性毒性和治疗期间出现的不良事件(TEAE)。次要终点包括ORR、DoR、PFS、OS等。
在接受双联Dato-DXd联合帕博利珠单抗的患者中,既往未经治疗和经治疗的患者间的客观缓解率(ORR)为38%。在接受三联Dato-DXd联合帕博利珠单抗和铂类化疗的患者中,ORR为49%。尽管数据不成熟,但是在双联治疗队列中,中位无进展生存期(PFS)为8.3个月,在三联治疗队列中则为7.8个月。
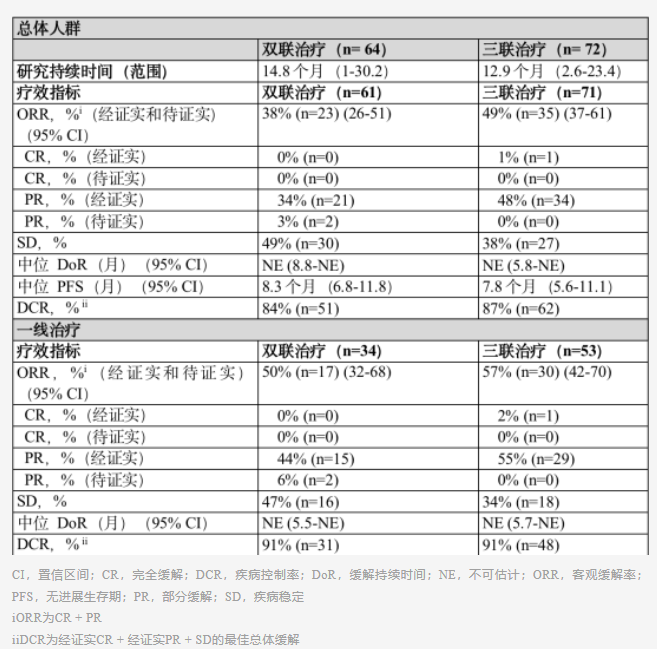
Dato-DXd联用方案的安全性特征与既往数据一致,未发现新的安全性信号。接受双联治疗和三联治疗的患者中,发生3级或以上治疗相关不良事件(TRAE)的比率分别为31%和58%。在双联治疗队列和三联治疗队列中,任何等级下最常见的不良事件分别为口腔黏膜炎(56%和35%)、恶心(41%和47%)、贫血(21%和48%)和疲劳(31%和37%)。独立委员会将27例间质性肺疾病(ILD)或非感染性肺炎事件判定为药品相关事件,各队列间发生率相似。大多数ILD或非感染性肺炎事件为低级事件,其中1/2级事件共23例,3级事件4例。
EGFR-TKI耐药
KEYNOTE-789研究KEYNOTE-789研究:是一项随机对照、III期研究,评估“K药+化疗”能否为EGFR-TKI治疗耐药的EGFR突变转移性非小细胞肺癌(NSCLC)患者带来获益。本次会议汇报了研究结果。
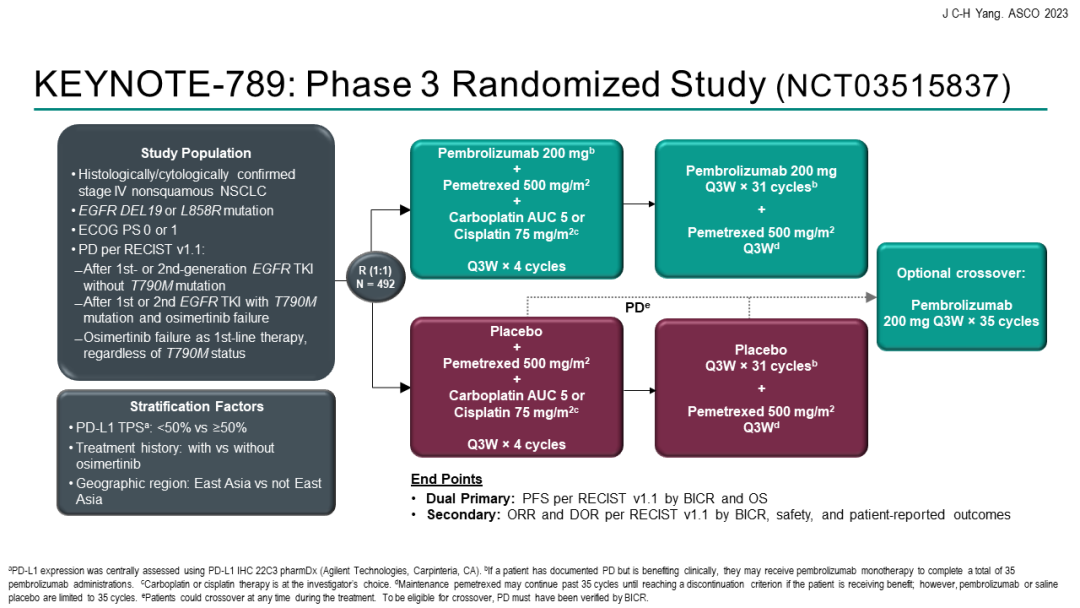
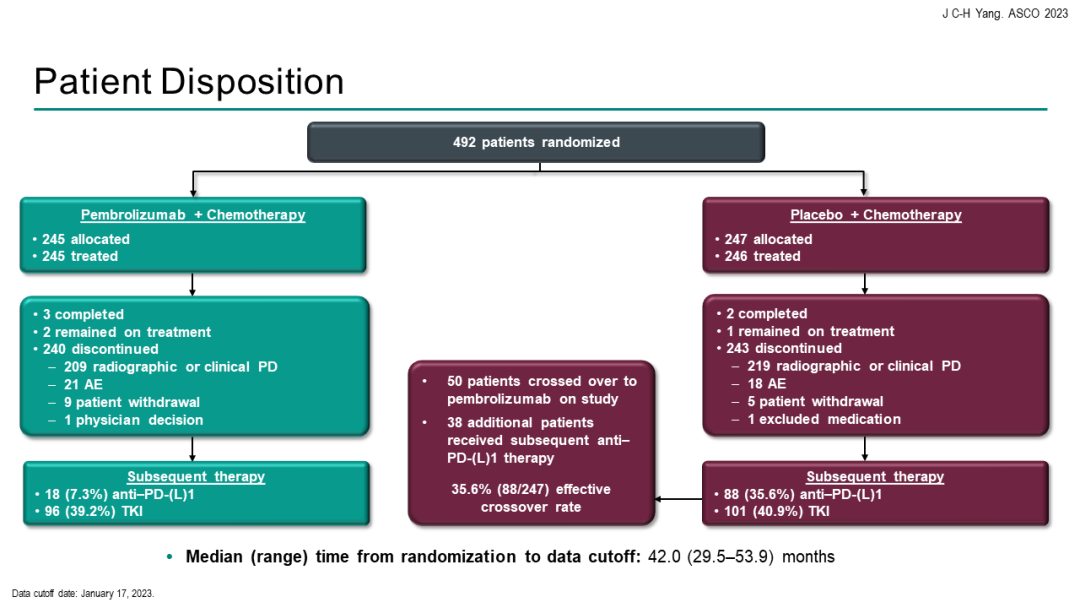
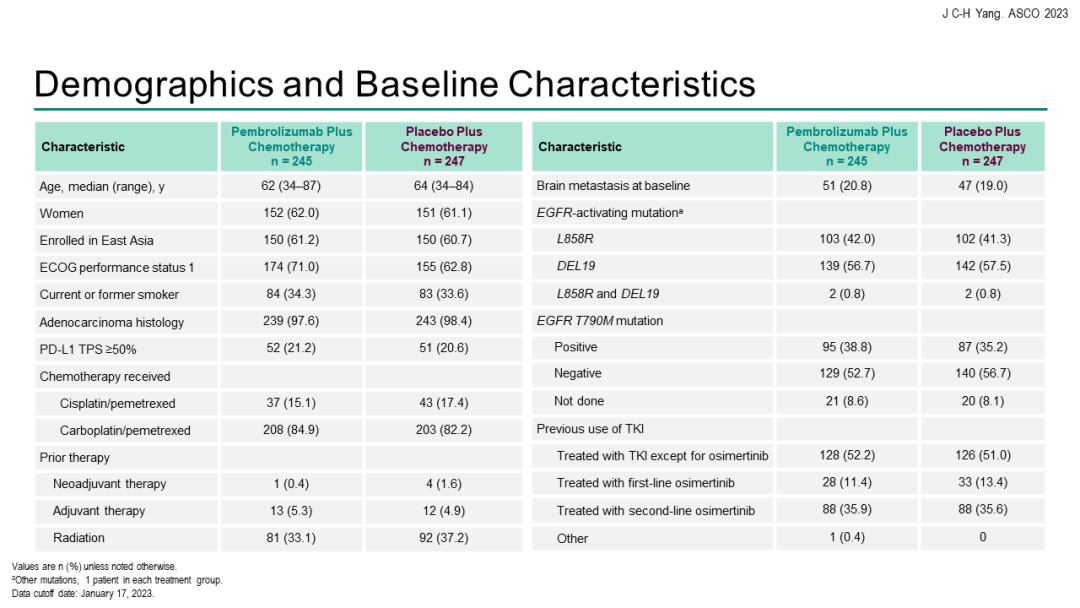
结果显示,在245例接受1~2线EGFR-TKI治疗进展的EGFR突变阳性晚期NSCLC患者中,帕博利珠单抗+培美曲塞+含铂化疗 vs 单纯化疗未能显著改善中位PFS。经过中位42.0个月的随访,免疫联合组对比单纯化疗组的中位PFS分别为5.6个月 vs 5.5个月[HR=0.80(95%CI 0.65-0.97;P=0.0122)]。
左右滑动查看更多
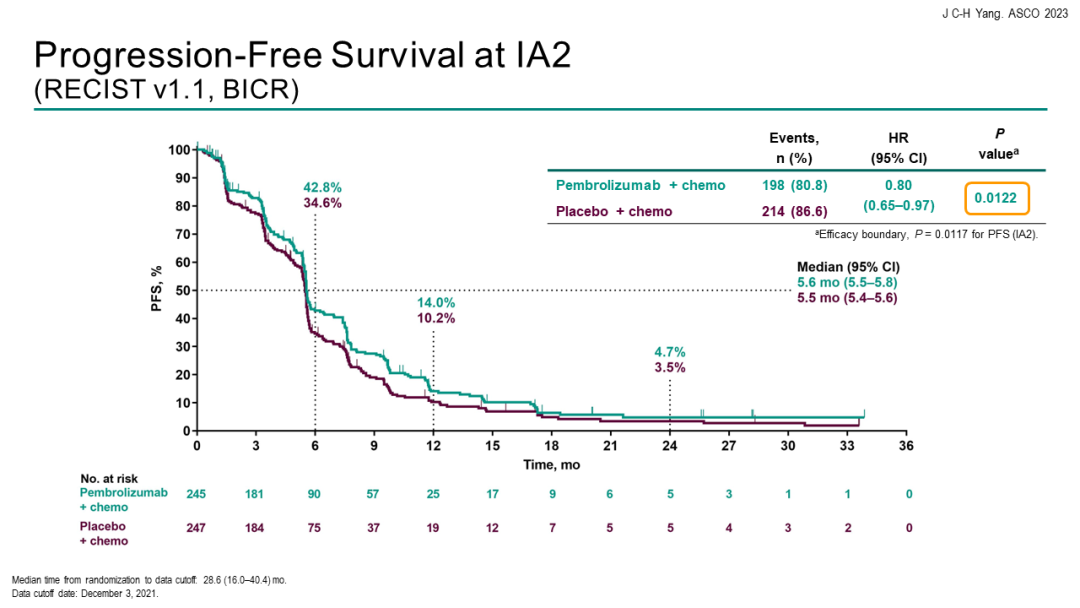
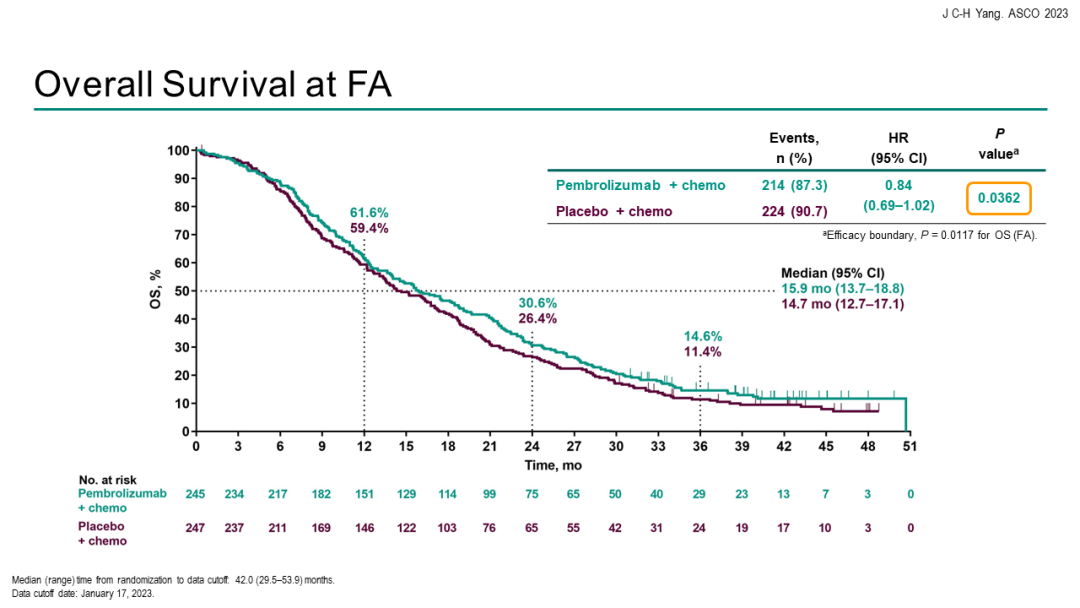
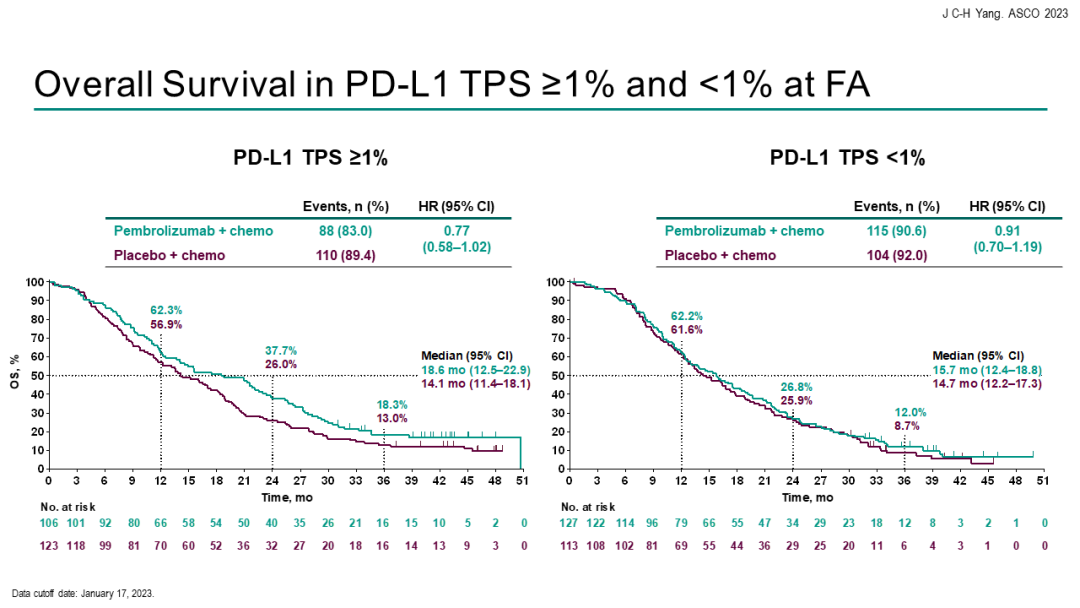
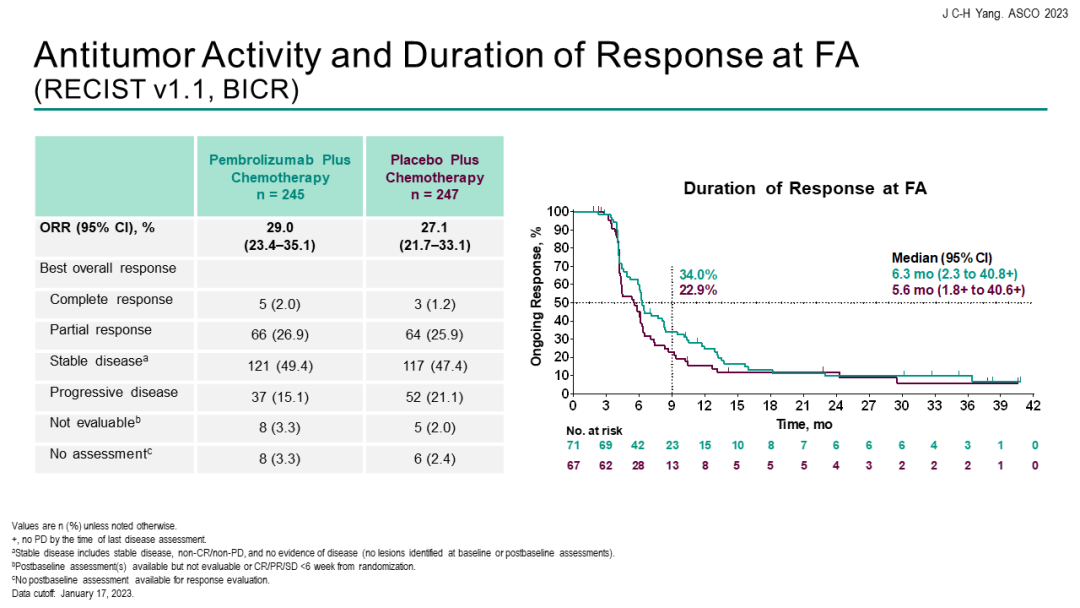
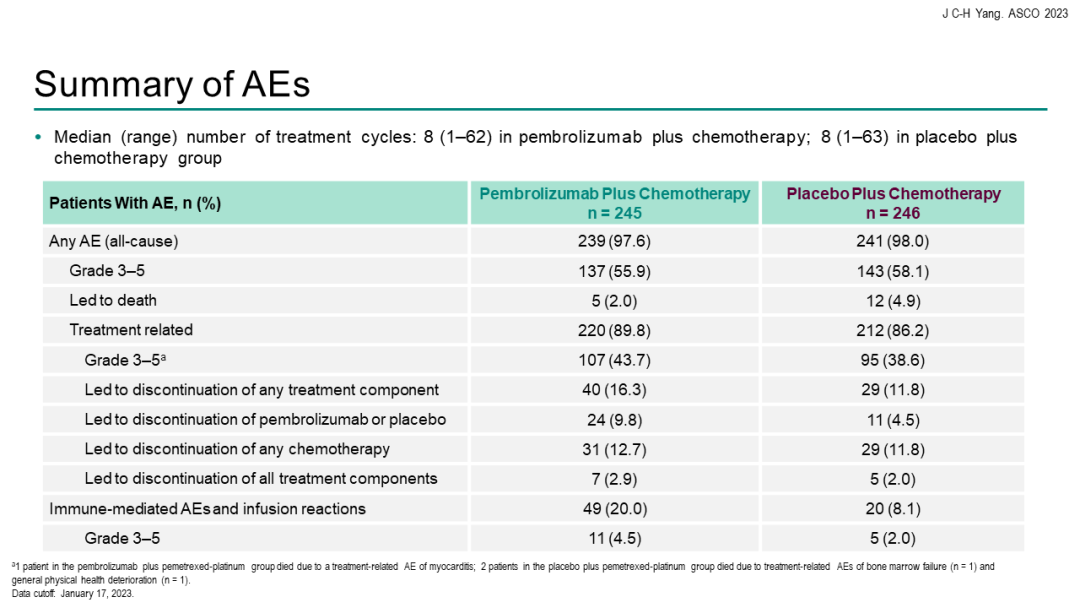
中位总生存期(OS)分别为15.9个月vs 14.7个月[HR=0.84(95%CI 0.69-1.02)]。客观缓解率(ORR)分别为29.0% vs 27.1%,中位持续缓解时间(DoR)分别为6.3个月 vs 5.6个月。安全性方面,帕博利珠单抗联合化疗组与单纯化疗组的3~5级治疗相关不良事件(TRAE)发生率分别为43.7%和38.6%。
参考资料
[1]Tsuboi M, Herbst R S, John T, et al. Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC[J]. New England Journal of Medicine, 2023.
[2]Herbst RS, Wu YL, John T, et al. Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial. J Clin Oncol. 2023 Apr 1;41(10):1830-1840. doi: 10.1200/JCO.22.02186.
[3]H. Wakelee, M. Liberman, T. Kato, et al. Perioperative Pembrolizumab for Early-Stage Non–Small Cell Lung Cancer. NEJM.ORG.June 3, 2023. DOI: 10.1056/NEJMoa2302983
[4]https://mp.weixin.qq.com/s/JCS-irXnHI_FJ_a2t67axw,第一三共微信官网
免责申明:本文中的信息仅供一般参考之用,不可直接作为医生、患者或者任何主体决策内容,“e药安全”不对任何主体因使用本文内容而导致的任何损失承担责任。
推荐阅读
患者招募,临床试验汇总
肺癌系列文章汇总
肺癌相关指南及专家共识大汇总
新药咨询或进群交流加微信:251170937肺友交流群、同行交流群(点击)
本文作者




原文地址:http://mp.weixin.qq.com/s?src=11×tamp=1686189214&ver=4577&signature=kVumeMrVXHzwRSjmtRSaTVT7gvHxJxMOQyVqEJkyCtouPcWYbQvWUPReq7YnVTXZR2p63eWBBqnZMeT4Usz-dCnPUZwryZH5JM49ZyBGCRsEkMk2NQ7F55n2DGUULk*M&new=1 |
|