|
|
作者:奇点肿瘤探秘
*仅供医学专业人士阅读参考


肿瘤浸润调节性T细胞(TI-Treg)由于强大的免疫抑制作用,一直被认为是强有力的免疫治疗靶点,但是人体中的Treg有很多种,为了避免严重自身免疫毒性,需要严格靶向TI-Treg,避开外周Treg(P-Treg),而且Treg的转录谱广泛包含了其他可激活的T细胞,因此,靶向疗法还需要避开抗肿瘤的细胞毒性CD8和CD4 T细胞[1,2]。
目前大部分Treg靶向药物无法满足如此复杂的设计需求,在小鼠中取得的成功也未能转化到人类患者中。
最近,哥伦比亚大学欧文医学中心的研究团队发表了最新研究,利用恶性肿瘤患者捐赠的样本,初筛出了17个主要调节因子,作为TI-Treg转录状态的决定因素,并利用CRISPR-Cas9等技术确定了1个最重要的主要调节因子TRPS1,靶向敲除后可以显著抑制肿瘤生长,且不影响其他T细胞亚型活性,在参与测试的药物中,低剂量吉西他滨是最能抑制这一主要调节因子活性的。研究结果发表在《癌细胞》杂志上[3]。

此前,研究人员已经开发出了用于组装和查询谱系特定基因调控网络的方法,包括精确细胞网络重建算法(ARACNe)和虚拟蛋白质组学富集规则分析算法(VIPER),这些方法可以筛选出主要调节因子(MR)蛋白,代表了病理生理和发生转化的细胞转录状态的机制驱动因子。
这一次,研究人员尝试利用这些方法构建一个能够区分TI和P-Treg特征的Treg特异性基因调控网络。他们收集了36例恶性肿瘤(8例胶质母细胞瘤、8例膀胱腺癌、8例透明肾细胞癌和12例前列腺腺癌)患者的肿瘤和外周血,分离出不同的T细胞谱系,包括TI-Treg、P-Treg、外周血CD4 T细胞,以及肿瘤浸润和外周血CD8 T细胞,并进行了RNA测序。
聚类分析显示,幼稚细胞和活化细胞明显分离,而肿瘤浸润细胞明显聚集,而且无论是基因表达还是蛋白活性,都不能依据肿瘤类型将TI-Treg进行分层,这表明了一种与肿瘤类型相对无关的转录状态。
算法提供了在TI和P-Treg中有显著活性差异的15个蛋白(AUROC=0.982),另外还有7个候选MR可以最高效地区分TI-Treg和其他T细胞亚群(AUROC=0.988),不过其中只有2个不在15个蛋白名单中,两者一结合,17个MR名单就诞生了。
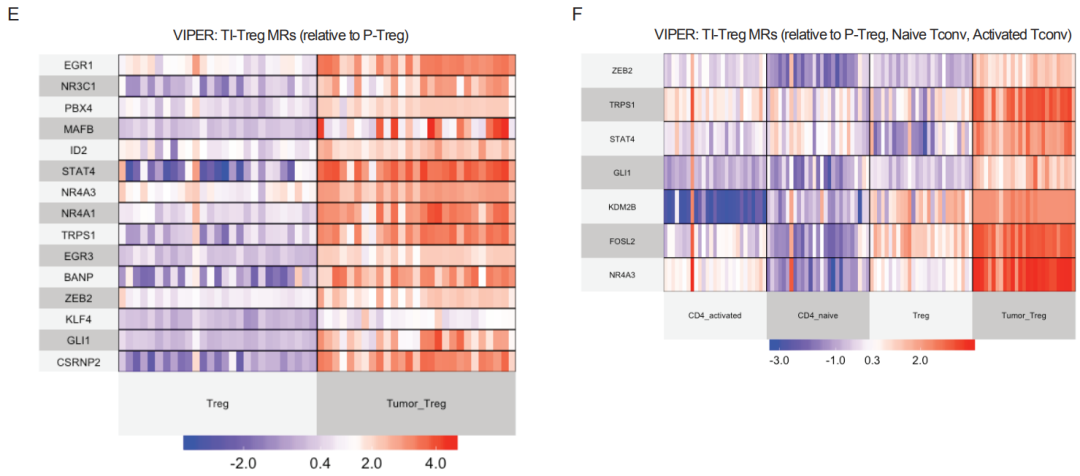
15个在TI和P-Treg中有显著活性差异的MR(E)
7个在TI-Treg和其他T细胞亚群中有显著活性差异的MR(F)
为了验证这些MR对TI-Treg在肿瘤微环境中的招募和/或维持是否是必要的,研究人员在小鼠中进行了体内混合文库CRISPR敲除筛选,17个MR中,有8个被证实在Treg的肿瘤浸润和/或维持中起到因果作用,其中6个具有Treg特异性功能,统计学意义最显著的为TRPS1。
无论在T细胞还是Treg中,此前,TRPS1的功能都是未知的。研究人员发现,Trps-1敲除小鼠和对照组相比,有明显的生存优势(p=0.047),6只Trps-1敲除小鼠中有3只观察到了自发的、持久的(>60天)肿瘤消退。这可能意味着,TRPS-1的活性对于肿瘤微环境中Treg的免疫抑制至关重要。
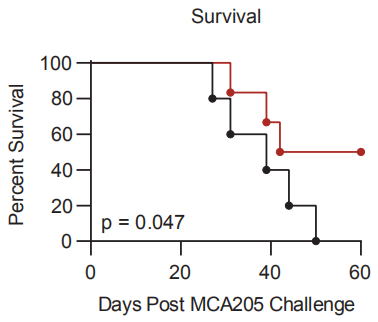
Trps-1敲除小鼠(红)相比对照组具有生存优势
在1554种FDA批准的或正处于研究阶段的药物中,分析显示,有32种可以作为17个MR蛋白的抑制剂,其中7种会优先抑制TI-Treg,而不是P-Treg,在不同类型肿瘤患者中都是如此。
研究人员选择了其中3个效果最显著的药物,分别为吉西他滨、triapine(一种核糖核苷酸还原酶抑制剂)和氟脲苷,进行了进一步研究。剂量反应曲线显示,只有吉西他滨会让Treg活性随药物浓度而逐渐变化,另外2种的变化曲线都较为“突然”,很难选择药物适宜浓度,而且体外实验显示,吉西他滨只需要10nM即可起效,远低于临床相关浓度。
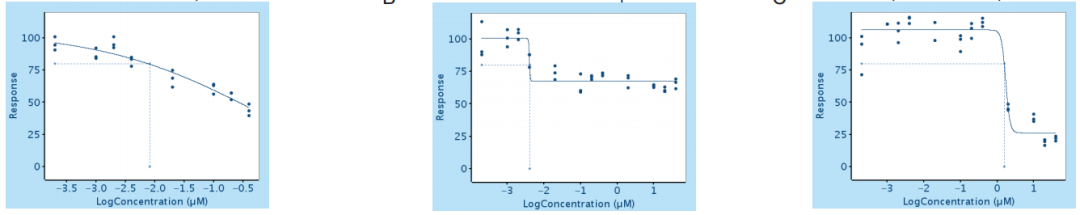
从左至右依次为吉西他滨、氟脲苷和triapine的剂量反应曲线
为此,研究人员选择了吉西他滨作为唯一的候选药物,进行了小鼠体内实验。
一部分小鼠移植了结肠肿瘤12天后启动吉西他滨治疗,此时对于它们来说正是抗PD-1免疫治疗的广泛耐药期,在第12天、15天和18天,它们分别接受了12mg/kg的吉西他滨腹腔注射,这是小鼠最低常规临床当量剂量(120mg/kg)的1/10,属于是很低剂量了。另一部分小鼠在同样的时间接受抗PD-1或吉西他滨联合抗PD-1治疗。
和预期结果差不多,小鼠对抗PD-1治疗根本不响应,而吉西他滨单药治疗则显著控制了肿瘤进展,与对照组相比,吉西他滨组肿瘤生长减慢(p=0.003)、生存期延长(p=0.006),联合治疗组运气也不错,低剂量吉西他滨恢复了肿瘤对抗PD-1治疗的敏感性,50%的小鼠完全缓解,使得它们相比吉西他滨单药组有更显著的生存优势(p=0.009)。
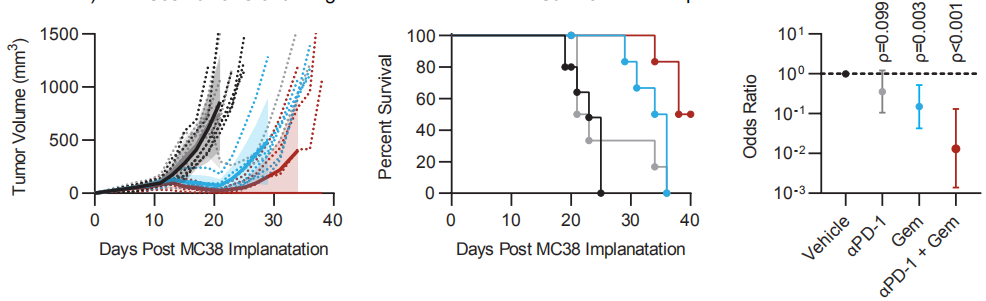
从左至右依次为四组小鼠的肿瘤体积变化、生存率变化和生存率OR,联合治疗组(红)明显更有优势
体外实验显示,对照组小鼠来源的脾脏Treg占比7.8%,TI-Treg则高达30.1%,吉西他滨治疗后,TI-Treg占比降至14.9%,而脾脏Treg占比几乎没有变化,这表明,低剂量吉西他滨确实对TI-Treg具有拮抗作用。
总的来说,这项研究发现了TI-Treg的重要调节因子TRPS1,确定了TRPS1的作用,以及潜在的TI-Treg靶向药物吉西他滨,为TI-Treg靶向治疗的可行性补充了有力证据。
参考文献:
[1] Chao J L, Savage P A. Unlocking the complexities of tumor-associated regulatory T cells[J]. The Journal of Immunology, 2018, 200(2): 415-421.
[2] Freeman Z T, Nirschl T R, Hovelson D H, et al. A conserved intratumoral regulatory T cell signature identifies 4-1BB as a pan-cancer target[J]. The Journal of Clinical Investigation, 2020, 130(3): 1405-1416.
[3] Obradovic A, Ager C, Turunen M, et al. Systematic Elucidation and Pharmacological Targeting of Tumor-Infiltrating Regulatory T Cell Master Regulators[J]. Cancer Cell, 2023.

本文作者丨应雨妍
原文地址:http://mp.weixin.qq.com/s?src=11×tamp=1683548685&ver=4516&signature=EC49qEVY7ulMjNuMSvE0l-7LdOsPPX1-CNgGd6ByI3fkI4dCx2XjclNWzMNVj-E8zDNl42RHQ0-EHZHUrMvPKIvay1mWmKZH-qzhngkpklHU0QA6AXCzJRMuwry91WG-&new=1 |
|