马上注册,阅读更多内容,享用更多功能!
您需要 登录 才可以下载或查看,没有账号?立即注册 
×
APPLE是一项开放标签III期临床试验,旨在评价贝伐珠单抗联合阿替利珠单抗治疗晚期非鳞状非小细胞肺癌(NSCLC)的疗效和安全性。
背景:
PD-1/PD-L1抑制剂联合化疗已成为转移性非小细胞肺癌(NSCLC)的标准一线治疗,但仍有部分患者会在治疗后产生耐药。目前已有多项临床试验正在进行中,主要目的是为了探索在PD-1/PD-L1抑制剂联合铂类双药化疗的基础上增加其他靶点的免疫检查点抑制剂能否改善晚期NSCLC患者的生存结局。
贝伐珠单抗是一种抗血管内皮生长因子(VEGF)单克隆抗体,已有研究证明在标准铂类化疗中加用贝伐珠单抗可改善非鳞状NSCLC患者生存获益,还可延长肾癌和肝细胞癌患者的无进展生存期(PFS)。临床前研究提示,靶向VEGF可通过使肿瘤血管正常化、增加T细胞浸润、促进树突状细胞成熟和减弱免疫抑制细胞活性诱导免疫应答。鉴于VEGF抑制剂的潜在免疫调节作用,特开展了一项多中心、随机的III期APPLE试验,旨在评估在PD-1/PD-L1抑制剂联合铂类双药化疗的基础上加用贝伐珠单抗治疗晚期非鳞状NSCLC的疗效。
方法:
APPLE是一项多中心、开放标签的III期随机临床试验,研究纳入年龄≥20岁、ECOG PS评分为0~1、既往未接受过细胞毒性药物化疗和PD-1/PD-L1抑制剂治疗、局部晚期、转移性或复发的非鳞状NSCLC患者为研究对象,以1:1的比例随机分配接受阿替利珠单抗(1200mg)+卡铂(AUC 5mg/mL/min)+培美曲塞(500mg/m2)(APP组)或阿替利珠单抗+卡铂+培美曲塞+贝伐珠单抗(15mg/kg)治疗(APPB组)。4个周期的诱导治疗后,分别接受阿替利珠单抗+培美曲塞或阿替利珠单抗+培美曲塞+贝伐珠单抗进行维持治疗。
主要终点是盲态独立中心(BICR)评估的PFS,次要终点包括总生存期(OS)、研究者(INV)评估的PFS、客观缓解率(ORR)、缓解持续时间(DOR)和安全性。
结果:
患者特征
研究纳入符合条件的患者412例(APP组206例,APPB组206例),APP组的206例和APPB组的205例患者纳入意向治疗分析(ITT)人群,其中273例(66%)患者为男性,138例(34%)患者为女性,中位年龄为67.0岁。APP组的205例和APPB组的205例患者纳入安全性分析,两组各有62例患者驱动基因阳性。
在ITT人群中,APP组和APPB组中分别有159例(77%)和159例(78%)患者完成了4个周期的诱导化疗,138例(67%)和129例(63%)患者因疾病进展停止治疗。APP组和APPB组中阿替利珠单抗治疗的中位周期数分别为9个和10个,APPB组中贝伐珠单抗治疗的中位周期数为9个。APP组和APPB组中分别有152例(74%)和155例(76%)患者接受了至少1种后续的抗癌治疗。
疗效
在ITT人群中,APP组和APPB组中分别有174例(84%)和176例(86%)患者发生疾病进展或死亡,BICR评估的中位PFS分别为7.7个月(95%CI:7.6-9.7)和9.6个月(95%CI:7.8-10.4)(HR,0.86)(图1A)。数据截止时,APP组和APPB组中分别有109例(53%)和99例(48%)患者死亡,中位OS分别为25.3个月(95%CI:21.0-31.1)和29.4个月(95%CI:23.9-34.0)(HR,0.86)(图1B)。
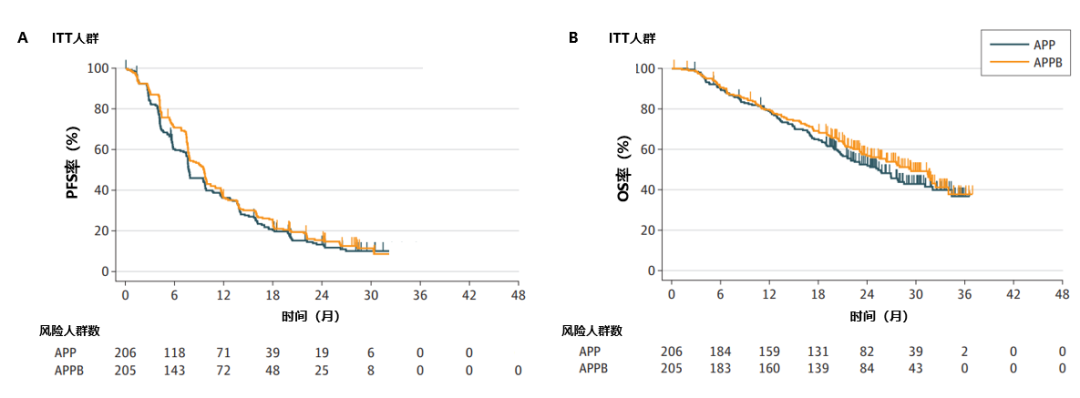
图1. ITT人群中APP组和APPB组患者的PFS和OS情况
在驱动癌基因阳性的患者亚组中,APP组和APPB组经BICR评估的中位PFS分别为5.8个月(95%CI:5.1-7.8)和9.7个月(95%CI:7.5-11.7)(HR,0.67)(图2A),中位OS分别为20.8个月(95%CI:17.1-27.7)和32.0个月(95%CI:22.0-未达到[NR])(HR,0.63)(图2B);在驱动癌基因阴性或未知的患者亚组中,APP组和APPB组经BICR评估的中位PFS分别为9.5个月(95%CI:7.6-12.8)和9.3个月(95%CI:7.7-11.6)(HR,0.97)(图2C),中位OS分别为26.9个月(95%CI:22.0-NE)和28.0个月(95%CI:23.1-32.4)(HR,0.99)(图2D)。在驱动癌基因阳性的患者亚组中,既往接受过EGFR-TKI治疗的患者,接受APP和APPB治疗的中位PFS分别为5.7个月(95%CI:4.3-7.7)和9.6个月(95%CI:7.5-11.7)(HR,0.70),中位OS分别为20.5个月(95%CI:16.9-31.1)和31.4个月(95%CI:21.4-NE)。
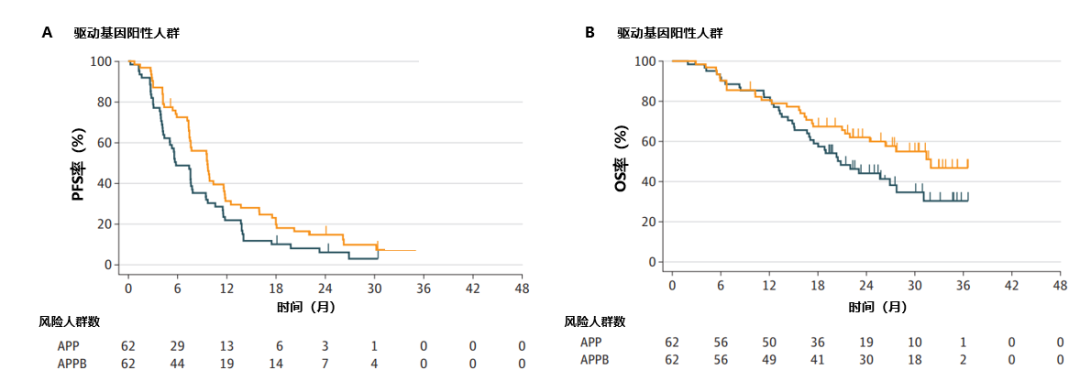
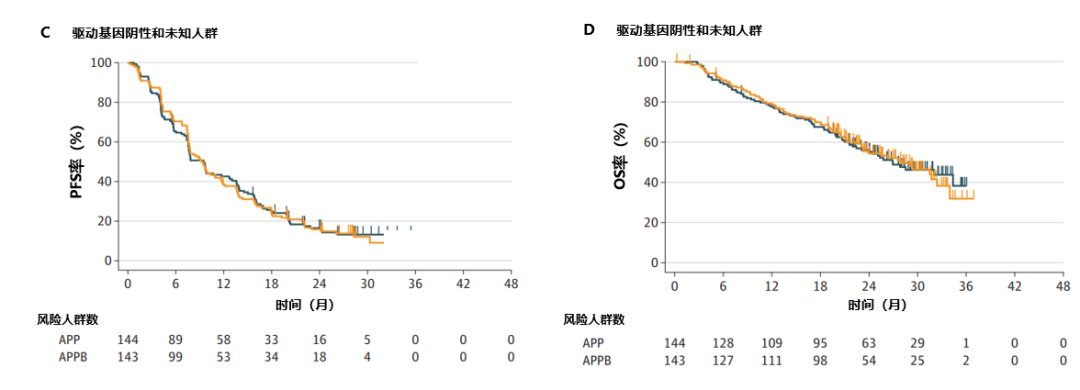
图2. 驱动基因阳性(A、B)和驱动基因阴性和未知(C、D)人群中APP组和APPB组患者的PFS和OS情况
在ITT人群患者中,APPB组和APP组的ORR分别为62%和51%,中位DOR分别为10.2个月(95%CI:8.2-13.1)和12.4个月(95%CI:8.3-12.7)。
安全性
APP组和APPB组分别有203例(99.0%)和204例(99.5%)患者发生治疗相关不良事件(TRAE),APP组≥3级贫血(18%vs11%)和≥3级高血压(8%vs1%)的发生率高于APPB组,其他≥3级TRAE的发生率相似;APPB组所有级别鼻出血(26%vs1%)、高血压(35%vs3%)或蛋白尿(30%vs5%)的发生率高于APP组。APP组和APPB组最常见的≥3级TRAE包括中性粒细胞计数下降(28%vs27%)、血小板计数减少(13%vs11%)、白细胞计数减少(13%vs14%)和发热性中性粒细胞减少(10%vs6%)。APPB组和APP组分别有5例(2%)和1例(0.5%)患者因TRAE死亡。
结论:
APPLE试验结果表示,对于非鳞状NSCLC患者来说,尽管在阿替利珠单抗+卡铂+培美曲塞(APP)的基础上加用贝伐珠单抗(APPB)未能显著改善PFS获益(9.6个月vs7.7个月),但APPB组的患者在9个周期的贝伐珠单抗治疗后继续显示出可控的安全性。同时,对于驱动癌基因阳性的患者来说,与APP治疗相比,APPB方案更能延长患者OS(20.8个月vs32.0个月)。
PD-1/PD-L1抑制剂联合化疗是转移性非小细胞肺癌的标准一线治疗,对于耐药患者尝试在标准方案加入其他药物,而抗VEGF单抗(如贝伐珠单抗)凭借其潜在免疫调节作用开始了在非小细胞肺癌中的探索。
贝伐珠单抗有望通过阻断血管内皮生长因子介导的免疫抑制,同时还能增强化疗和PD-1/PD-L1抑制剂的疗效,但尚需进一步的数据支持。III期APPLE试验旨在评估在PD-1/PD-L1抑制剂联合铂类双药化疗的基础上加用贝伐珠单抗治疗晚期非鳞非小细胞肺癌的疗效和安全性,初步分析结果表明,尽管在阿替利珠单抗+卡铂+培美曲塞(APP)的基础上加用贝伐珠单抗(APPB)未能显著改善PFS获益,但APPB组的患者在9个周期的贝伐珠单抗治疗后继续显示出可控的安全性。同时,对于驱动癌基因阳性的患者来说,与APP治疗相比,APPB方案更能延长患者OS(20.8个月vs32.0个月)。
【参考文献】 Shiraishi Y, Kishimoto J, Sugawara S, Mizutani H, Daga H, Azuma K, Matsumoto H, Hataji O, Nishino K, Mori M, Shukuya T, Saito H, Tachihara M, Hayashi H, Tsuya A, Wakuda K, Yanagitani N, Sakamoto T, Miura S, Hata A, Okada M, Kozuki T, Sato Y, Harada T, Takayama K, Yamamoto N, Nakagawa K, Okamoto I. Atezolizumab and Platinum Plus Pemetrexed With or Without Bevacizumab for Metastatic Nonsquamous Non-Small Cell Lung Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2023 Dec 21:e235258. doi: 10.1001/jamaoncol.2023.5258. Epub ahead of print. PMID: 38127362; PMCID: PMC10739077.
|