马上注册,阅读更多内容,享用更多功能!
您需要 登录 才可以下载或查看,没有账号?立即注册 
×
文┃杨衿记
作者单位:广东省医学科学院 广东省肺癌研究所
1背景
“癌基因成瘾”(oncogene addiction)是指具有特定变异基因的癌症依靠单一过度活跃的癌基因来增殖和生存的分子生物学行为。如慢性髓性白血病的BCR-ABL融合基因,非小细胞肺癌(non-small-cell lung cancer,NSCLC)的表皮生长因子受体(epidermal growth factor receptor,EGFR)基因的活化突变和EML4-ALK融合基因,我们称之为“驱动癌基因”(driver oncogens)。瞄准驱动癌基因的新一代口服小分子靶向药物,包括酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs),治疗驱动癌基因阳性患者的客观疗效、生存期与生活质量等多方面要显著优于传统的化疗。因此,确定具有酪氨酸激酶活性的驱动癌基因,可望有助于开发新的分子靶向治疗,实现癌症患者的个体化治疗或精准医学(precision medicine)。
原癌基因MET(间质上皮转换)编码受体酪氨酸激酶c-MET(或称为MET)。MET与其配体HGF(hepatocyte growth factor, 肝细胞生长因子)结合,引起受体酪氨酸磷酸化并通过PI3K和AKT、STAT3或者RAS和MAPK激活下游信号通路。MET正常活化对于伤口愈合和胚胎发育是必需的,但一部分晚期恶性肿瘤MET信号通路过度活化导致细胞增殖、分裂、迁移和侵犯等生物学行为的上调。这种异常的MET信号通路可能来自MET基因的遗传改变或失调,迄今为止,越来越多的证据显示MET基因扩增可能是这部分恶性肿瘤的驱动癌基因,我们把唯一依赖MET基因扩增来增殖和生存的这类型肿瘤称之为MET扩增型肿瘤——METoma。尽管如此,除MET基因改变(包括多倍体、基因扩增和基因突变)外,过表达的c-MET和HGF也参与了MET分子信号转导通路的异常活化(见图1),哪些生物标志物才是METoma的疗效预测因子和预后因子?在精准医学时代,这个问题是METoma首先要面对的重大挑战。 2临床前研究提示c-MET可能作为治疗靶点
临床前数据显示,MET基因扩增肺癌细胞株依赖MET分子信号转导通路生长和存活。MET酪氨酸激酶抑制剂克唑替尼(crizotinib,PF-02341066)对c-MET扩增的胃癌细胞具有抗肿瘤作用,另一种MET TKI(PHA-665752)对MET扩增型肿瘤相当敏感。克唑替尼对体外MET扩增的细胞株和MET扩增的多个瘤种(胃癌、NSCLC、肾癌和前列腺癌)移植肿瘤动物模型的MET酪氨酸激酶产生抑制作用,与抑制ALK(anaplastic lymphoma kinase,间变淋巴瘤激酶)融合基因变体的酪氨酸激酶相类似。
研究发现,克唑替尼或MET的siRNA抑制MET扩增的NSCLC细胞MET信号通路,引起细胞凋亡,并伴随AKT和MAPK下游通路的ERK磷酸化减弱,但非激酶区域突变(外显子14的N375S或缺失突变)阳性的NSCLC细胞不出现这种现象,这些结果推测MET信号通路对维持MET基因扩增的NSCLC细胞生存是必需的,但对没有扩增和MET非激酶区域突变的细胞则不然,尽管MET-TKIs对MET激酶区域突变有作用。克唑替尼对MET扩增的肺癌移植肿瘤模型产生了显著的抗肿瘤效应,但对MET扩增阴性或MET突变者没有疗效。这些研究推测,基因扩增而不是基因突变使得MET基因成为驱动癌基因(oncogenic driver)。
因此,目前临床前研究显示,基因扩增而非基因突变赋予了MET基因可能是一种驱动基因。MET扩增的肿瘤细胞依赖(“成瘾addicted to”)持续活化的MET信号通路来维持生长与存活,在体外细胞和体内动物试验中,小分子MET抑制剂或通过靶向MET mRNA 的RNA干预抑制MET信号通路可取得显著的抗肿瘤疗效。这些发现为临床使用MET-TKIs靶向治疗MET基因扩增型肿瘤(METoma)提供了理论基础。
3原发c-MET基因扩增型肿瘤(METoma)的临床研究
迄今为止,个案报道显示MET基因扩增的NSCLC、脑胶质细胞瘤及胃食管癌对克唑替尼有效。一项多中心随机对照Ⅱ期试验入组了MET免疫组化(immunohistochemistry,IHC)阳性(IHC++或+++的细胞≥50%)晚期NSCLC患者,厄洛替尼联合MET单抗onartuzumab比厄洛替尼+安慰剂显著提高了无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。尽管如此,Ⅲ期试验却取得了阴性结果。
2014年ASCO年会口头报告了一项在研克唑替尼治疗MET扩增晚期NSCLC的Ⅰ期试验 (NCT00585195)的组成部分,荧光免疫原位杂交(FISH)法确诊为c-Met扩增的晚期NSCLC 患者分为3类:MET/CEP7 比值 ≥1.8-≤2.2 (低度扩增), >2.2-<5(中度扩增)和≥5(高度扩增),见图2。c-MET扩增在NSCLC人群中的发生率为7.4%(59/800),其中低、中、高度扩增患者的比例分别为3.6%(29/800)、3.0%(24/800)和0.8%(6/800)。c-MET扩增患者接受克唑替尼治疗,250mg,口服,每天两次。采用RECIST1.0标准评价肿瘤客观疗效。结果显示,低、中、高度扩增患者的有效率分别为0%(0/2)、17%(1/6)和67%(4/6),见图3。常见的不良事件包括腹泻(50%)、恶心(31%)、呕吐(31%)、周围性水肿(25%)和视觉障碍(25%),大多数不良事件为1度。本研究仍在继续入组中。研究者认为,c-MET扩增疾病可能代表了一种新治疗靶点的NSCLC分子亚型,尤其见于吸烟者;克唑替尼治疗中、高度c-MET扩增NSCLC患者取得了临床疗效;克唑替尼250mg bid耐受性良好且不良事件可以处理;这些发现支持对c-MET扩增NSCLC患者接受克唑替尼治疗的深入研究。探索MET/CEP7 最佳比值与克唑替尼临床获益相关性的研究正在进行中。 另一项高度选择的MET口服抑制剂AMG337首次治疗成人晚期实体瘤的Ⅰ期研究(NCT01253707)也在2014年ASCO年会获得了口头报告的机会。该研究评价了AMG337的耐受性、安全性、药代动力学和肿瘤客观疗效。c-MET过表达/扩增/突变的患者可以入组。至2013年10月,接受各个剂量组的患者共66人,可供肿瘤疗效评价(中心实验室数据)者45人:1例完全缓解(CR),4例部分缓解(PR),28例疾病稳定(SD),12例疾病进展(PD),见图4。其中8例c-MET扩增的患者,有7例是胃/食管癌(1例CR,4例PR,1例SD,1例PD),另一例肾细胞癌PD,见图5。研究者认为,AMG337治疗c-MET扩增亚型的晚期肿瘤患者可取得客观肿瘤疗效,MTD 300mg QD时扩大入组至50例患者。 2014年ASCO年会最后一项治疗MET阳性晚期实体瘤患者的Ⅰ期临床试验中,其中对于EGFR野生型NSCLC患者,如果MET IHC阳性但FISH阴性,则使用MET-TKI(INC280)无效,但FISH阳性则有效(2例),另1例FISH状态未知,也有效,见图6。因此,FISH阳性更重要,但IHC阳性可作为筛查手段。
在2014年11月亚太地区肺癌大会上,广东省肺癌研究所李安娜等报告了一项原发c-MET过表达晚期NSCLC患者接受克唑替尼治疗的前瞻性研究的初步结果。13例可评价客观疗效的患者中,有效率为46.2%(6/13),除1例没有足够标本做FISH法检测MET基因外,5例有效患者中3例显示MET基因扩增,而7例无效患者中仅有1例表现为MET基因扩增。因此,MET基因扩增晚期NSCLC对克唑替尼的有效率为75%(3/4)。
由此可见,更多的证据支持MET基因扩增的患者可能从相应的MET-TKI靶向治疗中获益,从基因扩增的角度看,MET基因是一种驱动基因,存在于NSCLC、胃肠道和其他晚期实体瘤。初步的证据似乎孕育着MET基因扩增型肿瘤“METoma”的新概念。
4MET剪接点突变与临床疗效
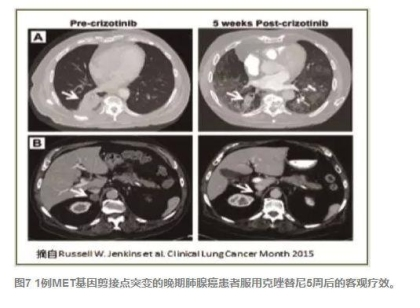
今年2月美国Dana-Farber癌症研究所报告了全球首例MET基因剪接点突变的晚期肺腺癌对克唑替尼有效(见图7)。该患者EGFR、KRAS、ALK、ROS1和RET等驱动癌基因均为阴性,但靶向二代测序(next generation sequencing, NGS)显示MET基因14号外显子剪接点突变(c.2887-18_2887-7del12),IHC提示50%癌细胞表现为磷酸化c-Met蛋白2+的阳性反应,与c-Met蛋白的活化状态相一致。最近肺腺癌全外显子测序的数据显示,MET基因14号外显子剪接点突变占了肺腺癌患者的4.3%,是MET基因扩增的两倍。尽管是个案报告,但隐藏的临床研发价值非常看好,临床靶向二代测序检测MET基因这种剪接点的突变,可能更有助于实现MET基因剪接点突变晚期肺腺癌患者的精准医学。
5存在问题
从循证医学的观点来看,目前原发MET基因扩增型肿瘤“METoma”主要有3项Ⅰ期临床试验的证据、一项前瞻性研究的初步结果和几项个案报告,因此,我们需要Ⅱ、Ⅲ期临床试验更高级别的证据。
何者是最佳的预测预后因子?
对于MET基因扩增型肿瘤“METoma”来说,在基因扩增、蛋白过表达和基因突变三个生物标志物中,基因扩增似乎证据比较多。此外,关于HGF作用的研究很少。这四个标志物的相互关系也不太清楚,给METoma的精准医学带来极大的挑战。
METoma精准医学未来的研究可能更集中于MET基因扩增和剪接点突变两个方面,同时,也应该阐明两者与c-MET蛋白过表达的相关性。
IHC检测c-MET蛋白过表达可能是METoma精准医学的过渡阶段,或者说,是一种筛查手段。
6展望
临床前数据、Ⅰ期临床试验和个案报道显示,原发MET基因扩增型肿瘤(NSCLC、胃食管癌、结直肠癌和脑胶质瘤等),对口服小分子化合物MET-TKIs如克唑替尼、INC280和AMG337等,初显不错的客观疗效,毒性可以接受,但仍需要Ⅱ/Ⅲ期临床试验级别更高的证据,我们有信心迎接“METoma”时代的到来。更重要的是,在METoma精准医学未来之路,最佳生物标志物的探索日显迫切。MET基因扩增、c-MET蛋白过表达和HGF,何者笑到最后?我们拭目以待。 |