|
|
作者:肿瘤资讯
整理:肿瘤资讯来源:肿瘤资讯
目前新辅助放化疗后行手术治疗是局部晚期可切除食管癌的标准治疗方案,食管癌患者生存率很大程度上取决于肿瘤对新辅助治疗的反应。然而,只有约16%~40%的食管癌患者在新辅助放化疗后术后病理可以达到病理完全缓解(pCR)[1]。近年来,多个免疫检查点抑制剂在食管癌一线治疗中显示出较好效果,其中替雷利珠单抗联合化疗一线治疗食管鳞癌的全球III期临床研究RATIONALE 306显示出了较长的生存获益,并获批食管癌晚期一线适应症。因此许多研究开始探究在食管癌治疗早期阶段加入免疫检查点抑制剂的疗效,替雷利珠单抗联合化疗的食管癌新辅助TD-NICE研究[2]已经见刊,但是替雷利珠单抗联合放化疗的食管癌新辅助治疗仍然是个空白。
在今年刚刚结束的ASCO大会上,公布了一项替雷利珠单抗联合放化疗治疗可切除的局部晚期食管鳞癌(ESCC)的II期研究(Poster摘要号:4068),旨在评估新辅助替雷利珠单抗联合放化疗治疗对可手术切除食管鳞癌患者的安全性和有效性。
摘要题目:新辅助替雷利珠单抗联合放化疗用于可手术切除局部晚期食管鳞癌(ESCC)的单臂Ⅱ期研究
Abstract Title: Neoadjuvant tislelizumab combined with chemoradiotherapy for resectable locally advanced esophageal squamous cell carcinoma (ESCC): single arm phase II study
通讯作者:杨文锋 孟雪
第一作者:金鹏
该项研究结果为可切除食管癌新辅助治疗与后续探索带来怎样的指导价值与启示?【肿瘤资讯】有幸邀请到杨文锋教授和孟雪教授,基于临床视角,深度剖析研究的临床意义,交流食管癌新辅助免疫治疗经验。
本期特邀点评专家—杨文锋 教授、孟雪 教授
杨文锋 教授山东省肿瘤医院
胸外科三病区主任、食管外科主任
博士、主任医师、硕士生导师
山东省医学会/胸外科分会/副主任委员
山东省临床肿瘤学会/食管癌专委会/主任委员
山东省抗癌协会/胸部肿瘤专委会/副主任委员
山东省医学会/肺癌食管癌多学科诊疗专委会/委员
山东省医学会/胸外科分会/食管学组/副组长
擅长肺、食管、贲门、纵隔肿瘤的微创手术
开展局晚期肺癌的手术治疗
开展食管癌治疗后复发的挽救性手术
开展食管癌新辅助及转化治疗后的手术治疗
孟 雪 教授山东省肿瘤医院特需二病区主任
主任医师、硕士/博士生导师
美国M.D Anderson肿瘤中心访问学者
美国密歇根大学医学院访问学者
中国抗癌协会“青年科学家”
山东省“泰山学者”青年专家
山东省优秀中青年保健人才
第十届山东省优秀科技工作者
首位获中国抗癌协会科技一等奖
首位获山东省科技进步二等奖
主持多项国家自然科学基金及省基金
山东省抗癌协会理事会常务理事
山东省抗癌协会肿瘤免疫与免疫治疗学分会主委
研究设计:
· 这是一项前瞻性的单臂临床试验。
· 共有20例初诊的可手术切除ESCC患者(cT1-2N+ / cT3-4aN0-3 M0)入组,共接受2个周期的替雷利珠单抗治疗(200mg,每3周一次,共2个周期),并接受同步放化疗(放疗方案:41.4Gy/23f;化疗:白蛋白紫杉醇100mg/m2,顺铂75mg/m2,每3周一次,共2个周期)。
· 患者在新辅助治疗后休息4-6周后进行根治性食管癌切除手术。入组患者在基线期和手术之前行PET/CT检查。
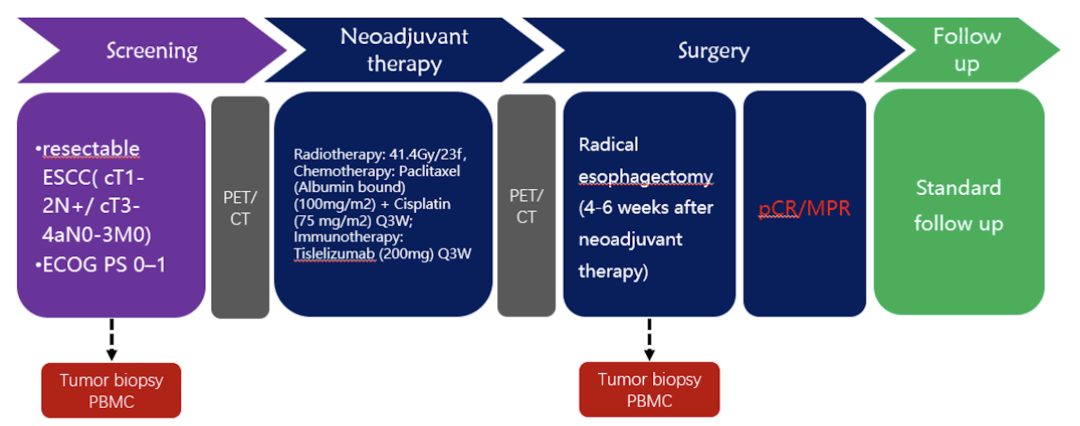
研究的主要终点包括完全病理缓解率(pCR)和主要病理缓解率(MPR),次要终点是无病生存率(DFS)和安全性。探索性终点包括分子影像学研究和免疫学生物标志物研究,以进一步探索影响食管癌新辅助治疗疗效的因素。
研究结果:
在入组的20例患者中,全部患者均接受了新辅助替雷利珠单抗联合放化疗的治疗方案,其中有18例患者完成了根治性食管癌切除术,1例患者因新辅助治疗后出现了淋巴结转移而转为接受根治性放化疗。1例患者在手术前死于肺炎(表1)。
表1 患者特征

疗效:在18例接受手术的患者中,R0切除率为100%(18/18),9例患者达到pCR(50.0%),13例患者达到MPR(72.2%)。
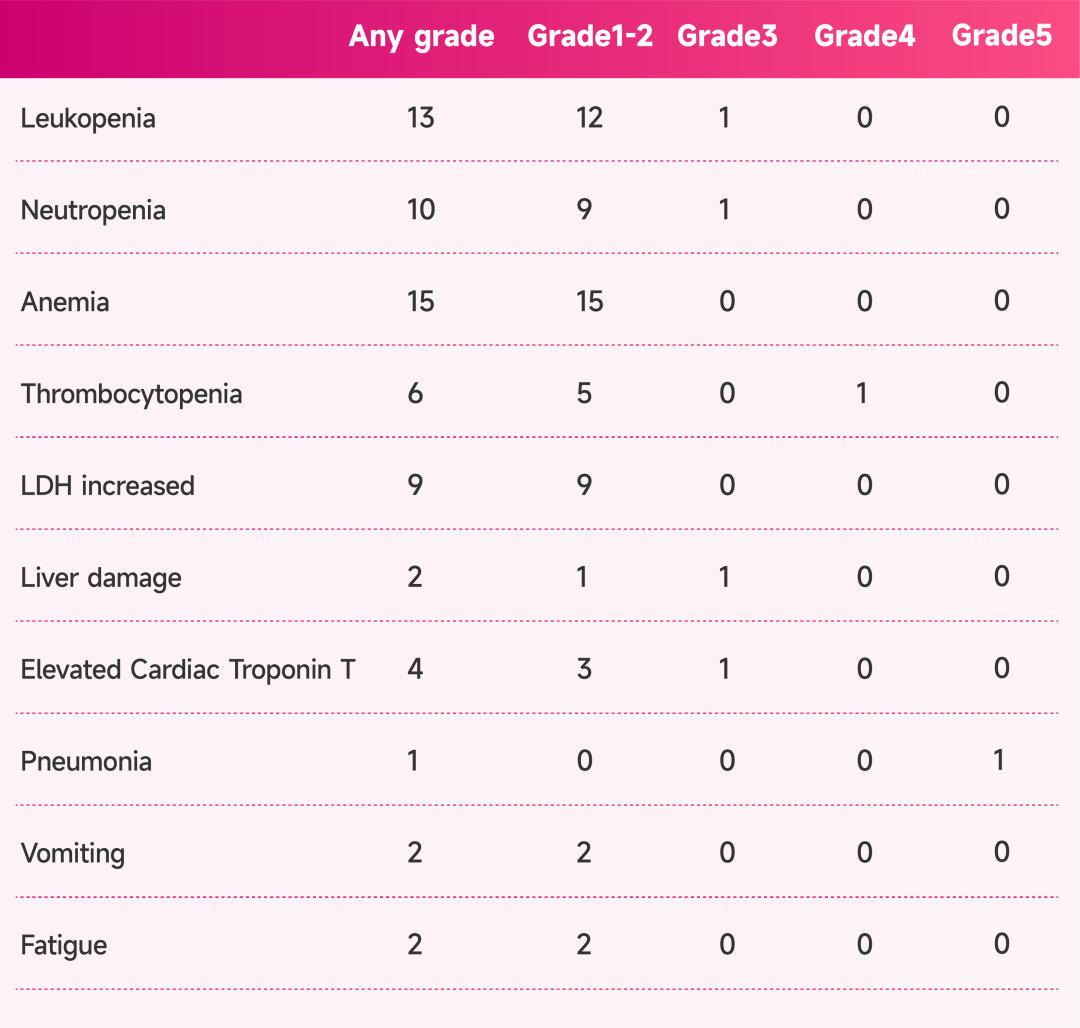
安全性:大多数治疗相关不良事件(TRAE)为1-2级,最常见的TRAE是贫血(15,75.0%),3级TRAE包括1例白细胞减少症(5.0%)、1例中性粒细胞减少症(5.0%)、1例肝损伤(5.0%)和1例肌钙蛋白T升高(5.0%)(表2)。
表2 治疗相关不良事件(TRAE)
探索性终点:分析患者的PET/CT检查发现,治疗后达到pCR和non-pCR患者的肿瘤部位SUVmax均有明显下降。non-pCR患者的基线期肿瘤SUVmax高于pCR患者(p=0.0642)(图2)。收集并分析患者外周血单个核细胞(PBMC)发现,在新辅助治疗后循环中的CD4+T细胞、CD4+效应记忆T细胞(Tem)和M1型巨噬细胞都有明显增加。在pCR患者中,治疗后的CD4+Tem和cDCs均高于无pCR患者,而调节T细胞(Tregs)和M2型巨噬细胞则较低(图3)。
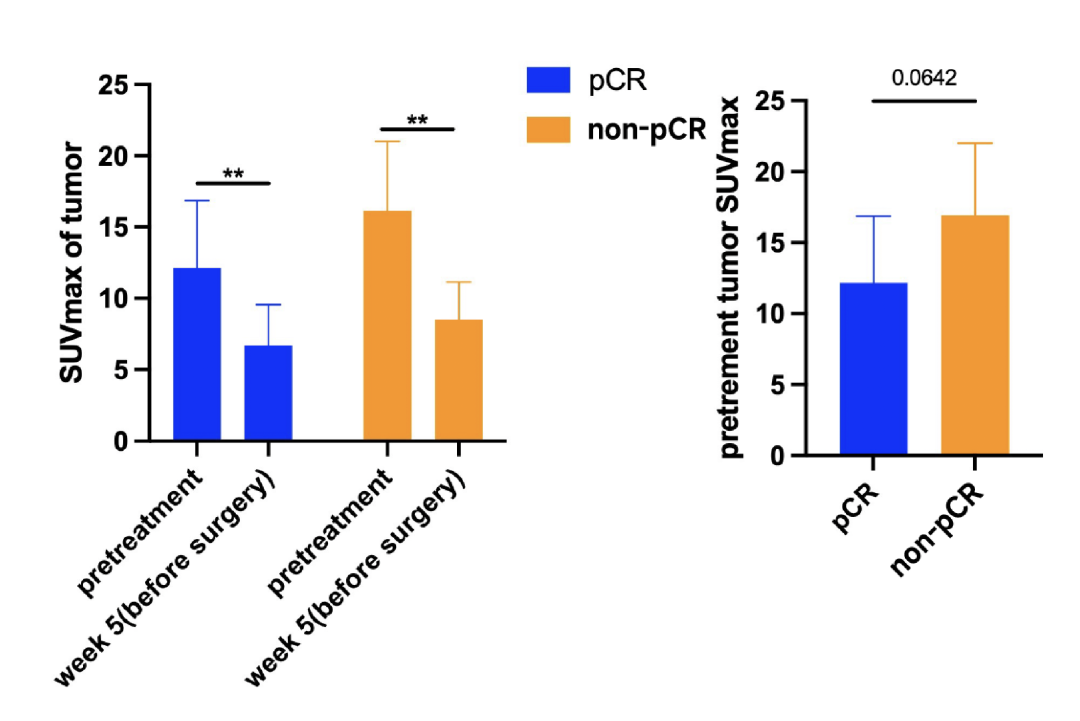
图2 治疗后,pCR和非pCR患者的SUVmax均显著降低。非pCR患者的基线SUVmax高于pCR患者。
图3 治疗后循环CD4+T、CD4+Tem、M1明显升高。pCR患者治疗后CD4+Tem和cDCs均高于非pCR患者,而Tregs和M2型巨噬细胞则较低
研究结论:
新辅助替雷利珠单抗联合放化疗治疗局部晚期可手术切除食管鳞癌具有较好的疗效和安全性。专家点评:杨文锋 教授
手术是局部晚期可切除食管癌的主要治疗方法,但单纯手术的治愈率低,仍有相当一部分患者出现复发和转移。基于多项评估术前新辅助治疗对比单纯手术的研究结果,新辅助同步放化疗后进行手术逐渐成为可切除局晚期食管癌的标准治疗方案。但新辅助放化疗术后non-pCR食管癌患者比例过半,其生存预后较差。随着近年来免疫检查点抑制剂在晚期食管癌一线治疗及可切除局部晚期食管癌辅助治疗中取得成功,逐渐进入研究者视野。该研究显示,在新辅助放化疗基础上加入替雷利珠单抗,在完成根治性食管癌切除术的患者中,R0切除率为100%,50%的患者达到pCR,72.2%的患者达到MPR,取得了非常好的疗效。pCR的提升,能否延长患者的DFS和转化成长期OS的获益,仍需要大样本的研究和较长时间的随访。
围术期方面,经过术前的新辅助放疗、化疗及免疫治疗后,手术中发现肿瘤组织与周围组织的黏连较重,尤其是局部晚期如T4a及T3期患者,治疗前淋巴结转移比较多的患者(如N2),术中组织游离比较困难,出血渗出比较多。术后组织渗出和胸腔引流液较多,并发感染的风险增大,吻合口瘘的发生风险增加。术后围术期管理尤为重要,谨防这些并发症的发生,术前要充分准备,术中要严谨操作,术后更要精细化的管理,加强营养支持,加强抗感染及对症治疗,把可能出现的问题消灭在萌芽之中。此研究表明术前新辅助放化疗和免疫治疗的联合,并未影响手术的R0切除率,值得进一步探讨。
专家点评:孟雪 教授
本研究在既往标准新辅助治疗方案的基础上,联合抗PD-1治疗,得到较好的治疗效果,pCR率达到50%,MPR率72.2%。在该项研究中,新辅助治疗阶段加入抗PD-1的治疗可能会通过增强宿主免疫力,减少肿瘤克隆异质性,促进效应T细胞激活对潜在的微转移病灶进行监视和清除,给患者带来更多获益。
由于放化疗和免疫检查点抑制剂治疗联合使用时的毒副反应,新辅助治疗阶段选择放化免联合治疗比较慎重,此临床研究结果显示病人的整体安全性较好。放疗在新辅助治疗中的巨大优势不容忽视,除了显著杀伤局部肿瘤以外,放疗还具有“免疫调节剂”的功能,包括增加肿瘤抗原释放,增加抗原呈递,促进免疫细胞的启动和激活,增加T细胞活化和浸润等。本研究通过使用抗PD-1治疗与新辅助放化疗联合,与单纯的化疗联合免疫治疗相比,增加了放疗的局部杀伤作用,更显著利用了放疗的调节免疫的优势。值得关注的是,我们也通过免疫学标记物研究发现了在治疗后所引发的一系列的全身性免疫反应,包括CD4+效应记忆T细胞(Tem)和M1型巨噬细胞等都有明显增加,尤其是与治疗效果欠佳的患者相比,在达到pCR患者循环中具有较高的CD4+Tem和DC细胞,而介导免疫抑制的调节性T细胞(Tregs)和M2型巨噬细胞则相对较低。本研究试图通过PET/CT来帮助准确识别需要新辅助免疫治疗的人群,在治疗前较高的肿瘤SUVmax提示较差的治疗效果,除了PD-L1的表达水平以外,是否可以通过基线期的PET/CT检查获取的代谢参数达到识别采用新辅助免疫联合放化疗的患者的目的,需要更大样本量的研究来证实。此外,通过新辅助治疗后检测人体免疫学标记物,也可以帮助制定个体化的术后治疗策略。我们期待该研究的最终结果,希望能够为局部晚期可手术食管癌患者带来更多的治疗策略选择和个体化治疗帮助。
参考文献
[1] Yang H, Liu H, Chen YP, et al. Neoadjuvant Chemoradiotherapy Followed by Surgery Versus Surgery Alone for Locally Advanced Squamous Cell Carcinoma of the Esophagus (NEOCRTEC5010): A Phase III Multicenter, Randomized, Open-Label Clinical Trial[J]. J Clin Oncol,2018;36(27):2796-2803.
[2] Yan X, Duan H, et al. Tislelizumab combined with chemotherapy as neoadjuvant therapy for surgically resectable esophageal cancer: A prospective, single-arm, phase II study(TD-NICE). Int J Surg. 2022 May 18;103:106680.
责任编辑:肿瘤资讯-云初
排版编辑:肿瘤资讯-高惠版权声明版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。
原文地址:http://mp.weixin.qq.com/s?src=11×tamp=1686671586&ver=4588&signature=uJiVGn6gDyU6whLgR19cpDaW2hWbrnKuTyQ2LTsj40YG-5JNxJXOSna8Q77BbXWhshatDWdZf5fxFhgKGSmcqCTqevGVmO8U6Dx6n4zbLmQ4T7eM-o9gNlwlKiPQen5L&new=1 |
|