|
|
作者:奇点肿瘤探秘
*仅供医学专业人士阅读参考


众所周知,存在错配修复缺陷(dMMR)/微卫星不稳定性高(MSI-H)的结直肠癌,肿瘤新抗原水平相对较高,更有利于免疫检查点抑制剂(ICIs)发挥,因此也是最早从PD-1/L1抑制剂治疗中获益的肠癌人群。
继治疗dMMR/MSI-H晚期肠癌患者的关键临床III期研究成功后[1],2022年登上《新英格兰医学杂志》的一项临床II期研究又显示,PD-1抑制剂新辅助治疗dMMR/MSI-H早期肠癌患者的临床完全缓解率是100%[2],前景一片大好!
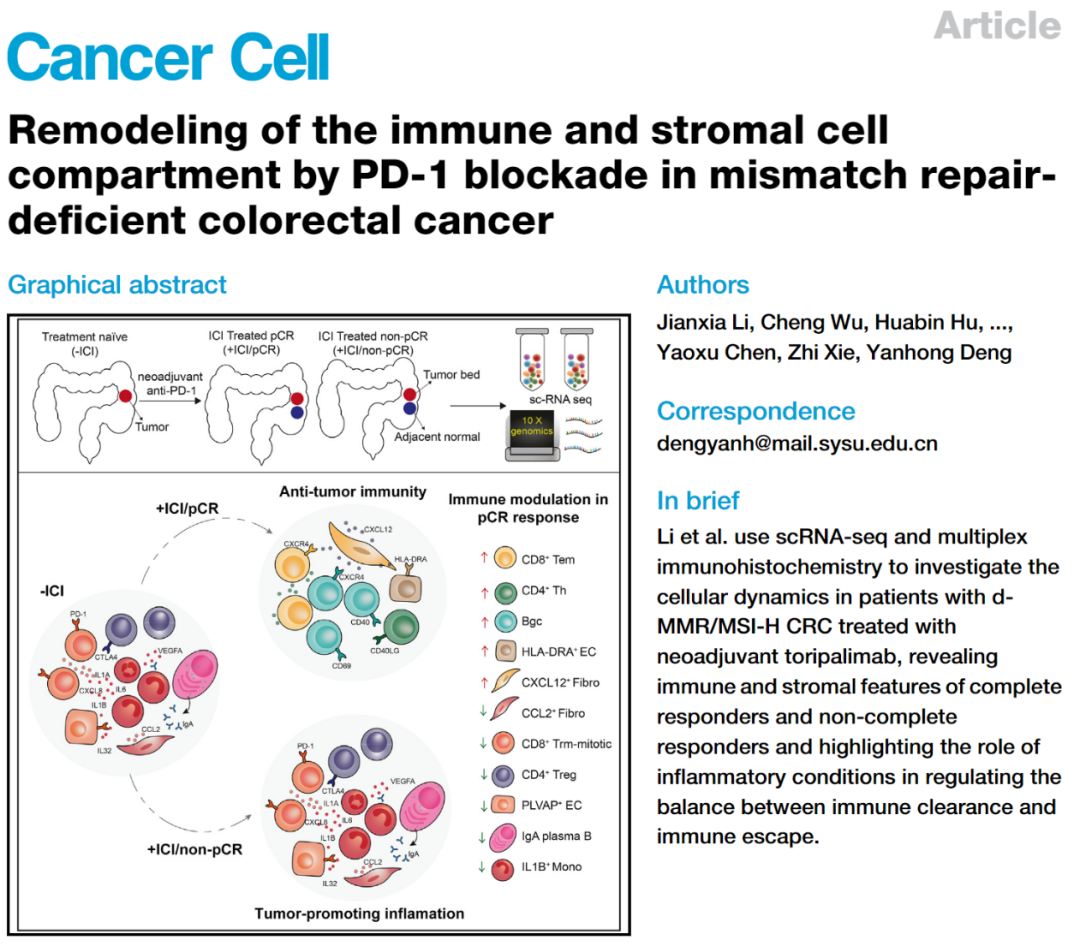
而近期在知名期刊Cancer Cell上,中山大学附属第六医院邓艳红教授团队发表了一项最新研究:借助单细胞测序技术,研究揭示了PD-1抑制剂新辅助治疗后,dMMR/MSI-H肠癌免疫微环境内免疫细胞和间质细胞变化情况,为免疫治疗的起效机制提供了最新见解,有望在未来帮助免疫治疗“乘胜追击”[3]。
论文首页截图
从各项临床研究报告的结果来看,PD-1抑制剂治疗dMMR/MSI-H晚期肠癌的客观缓解率(ORR)平均在50%左右,这个数字虽说不低了,但也意味着一半的患者对治疗无应答,瓶颈亟待突破。而且既往也还没有利用单细胞测序技术,分析结直肠癌在PD-1抑制剂治疗前后免疫微环境状态变化的研究。
基于这些考量,邓艳红教授团队开展了本次研究,前瞻性分析了一项临床II期研究中,19例接受PD-1抑制剂(特瑞普利单抗)±COX-2抑制剂塞来昔布新辅助治疗的dMMR/MSI-H局部晚期肠癌患者,在新辅助治疗期间对患者肿瘤及邻近正常组织进行取样,共有15例患者经治疗达到病理学完全缓解(pCR)。
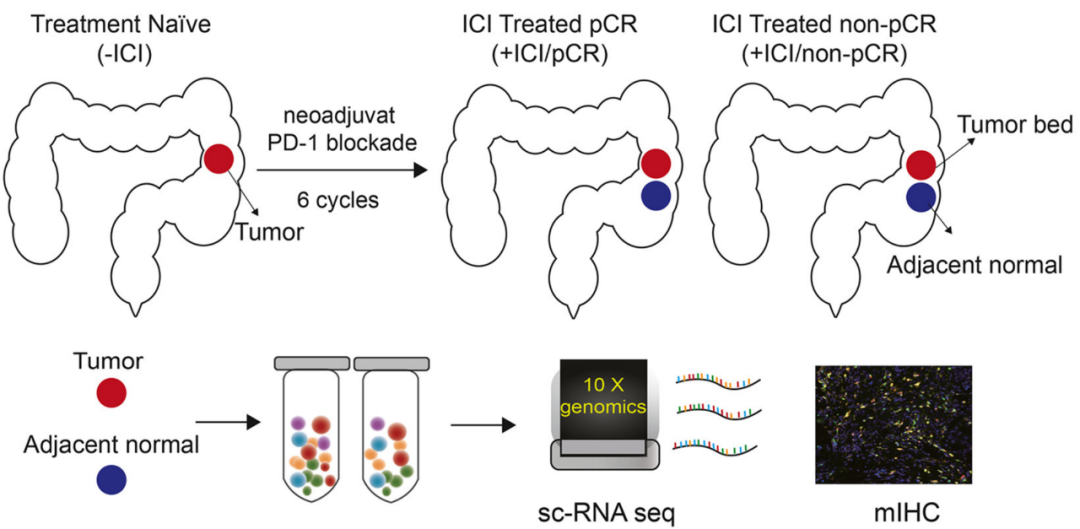
研究流程简图
与既往研究结果一致,dMMR/MSI-H肠癌样本中的CD8+细胞毒性T细胞浸润更多,且经治疗达到pCR的患者,T细胞基因表达的细胞毒性标签更显著;T细胞亚群分析显示,PD-1抑制剂治疗可诱导CD8+效应记忆T细胞(Tem Cells)和组织驻留-有丝分裂CD8+T细胞(Trm-mitotic)比例的显著改变。
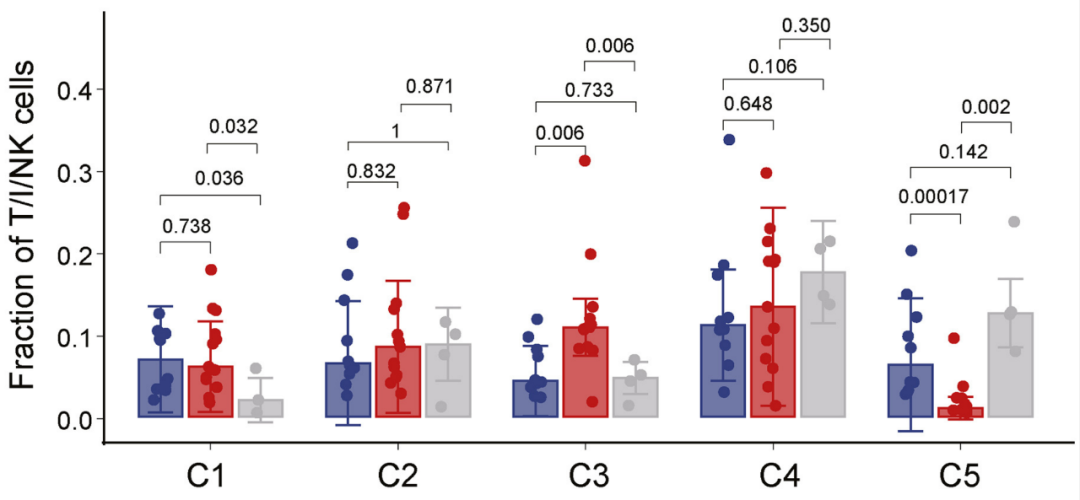
特定CD8+T细胞亚群数量在新辅助治疗前(蓝色柱)/后的变化情况,Tem Cells(C3)比例在pCR患者(红色柱)中显著上升,而Trm-mitotic(C5)比例显著下降
进一步分析显示,PD-1抑制剂治疗还上调了CD8+ Tem细胞的抗原呈递和IFN-γ应答相关基因(如HLA-DQA1、HLA-DRA和CD74 )表达水平,也使CD8+Trm细胞更易向Tem细胞转化,而表达增殖标志物基因的CD8+Trm-mitotic细胞则显著减少,这种改变整体有利于增强T细胞的抗肿瘤免疫应答。
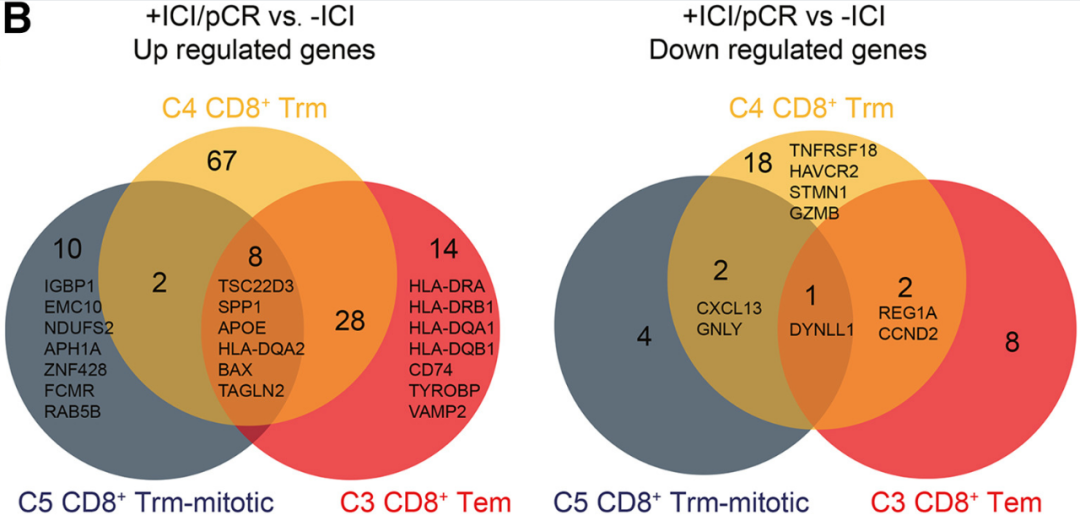
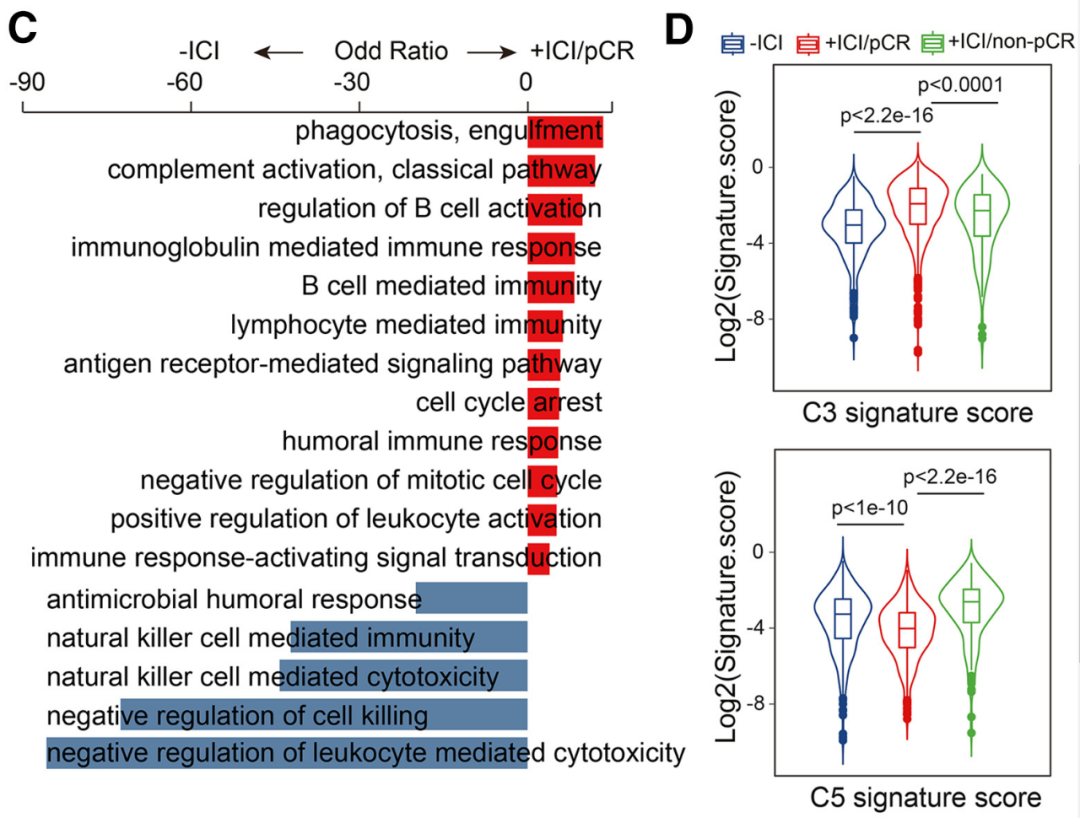
PD-1抑制剂治疗上调CD8+ Tem细胞的抗原呈递和IFN-γ应答相关基因表达水平
PD-1抑制剂治疗也减少了免疫抑制性CD4+调节性T细胞的数量,而有利免疫治疗的CD4+辅助性T细胞数量增加,这部分细胞还同时高表达CD40;以CD40为线索,研究团队又发现CD40+CD20+生发中心B细胞(Bgc Cells)与CD4+辅助性T细胞数量密切相关,两类细胞的相互作用可能会影响免疫应答。
研究团队又对dMMR/MSI-H肠癌样本中的髓系细胞进行分析,发现有利癌症发生的促炎性IL1B+单核细胞在PD-1抑制剂治疗后显著减少,残存细胞的促炎能力也显著下降,患者血清内的多种炎症因子就相应减少了。
而间质细胞也被PD-1抑制剂治疗所重塑,主要表现为参与促炎、促癌的CCL2+成纤维细胞(存在癌症相关成纤维细胞特征)占比下降,与抗原呈递、免疫细胞激活有关的HLA-DRA+内皮细胞占比上升。
经免疫新辅助治疗达到pCR的患者中,PD-1抑制剂对髓系细胞和间质细胞的重塑,整体减少了两类细胞中的促炎性亚群,而non-pCR患者中未观察到类似改变,免疫抑制性细胞亚群仍显著高表达,提示以促炎性细胞和分子、免疫抑制性微环境为目标,有望提高PD-1抑制剂对dMMR/MSI-H肠癌的疗效。
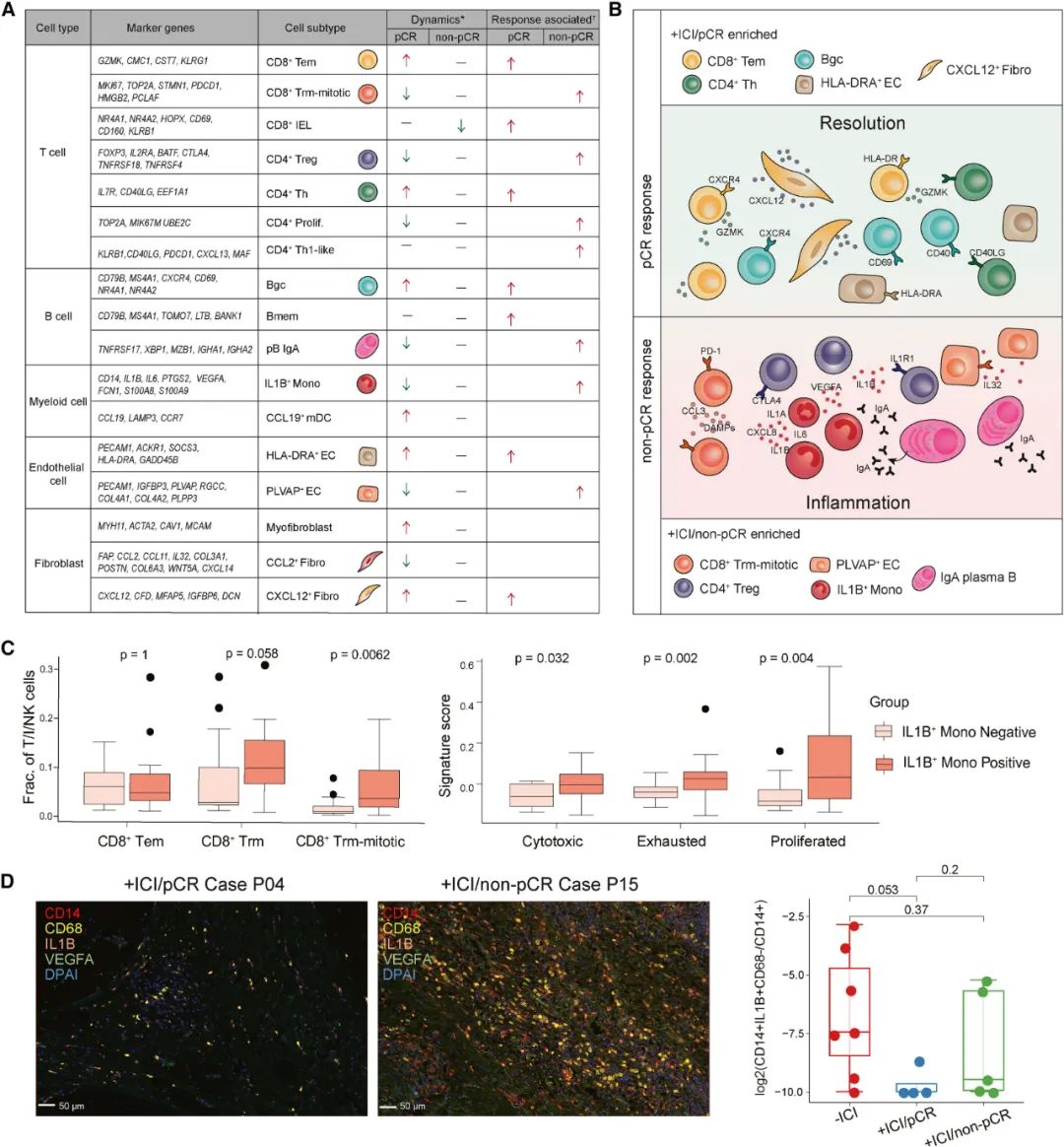
PD-1抑制剂在pCR患者中对免疫微环境促癌性炎症的显著改善
总而言之,本次研究进一步揭示了PD-1抑制剂对dMMR/MSI-H肠癌疗效显著的机制,也找到了制约免疫治疗效果的一些关键靶标,期待研究结果能尽快转化为新的治疗手段,帮助dMMR/MSI-H结直肠癌患者实现更好的长期生存。
参考文献:
[1]André T, Shiu K K, Kim T W, et al. Pembrolizumab in microsatellite-instability–high advanced colorectal cancer[J]. New England Journal of Medicine, 2020, 383(23): 2207-2218.
[2]Cercek A, Lumish M, Sinopoli J, et al. PD-1 blockade in mismatch repair–deficient, locally advanced rectal cancer[J]. New England Journal of Medicine, 2022, 386(25): 2363-2376.
[3]Li J, Wu C, Hu H, et al. Remodeling of the immune and stromal cell compartment by PD-1 blockade in mismatch repair-deficient colorectal cancer[J]. Cancer Cell, 2023.

本文作者丨谭硕
原文地址:http://mp.weixin.qq.com/s?src=11×tamp=1685495418&ver=4561&signature=FY8VTvTpOa6-zjtlgNdWfZJlzAr8RnQws98FzgKTEpXTppOpq3gsD8T5oD8crznm4m6WNAn9RDT0E7BpX7X9K*NC9pt3dG0ChOqqJHalOL5Y98P0RS6WY3GIQd7ftq9A&new=1 |
|