|
|
作者:ioncology
点击蓝字,关注我们

数百万亿微生物栖息于人体内,对各种生理功能、疾病、衰老、情绪和认知产生影响。尤其癌细胞内微生物群作为致癌重要因素,可以从周围组织迁移或血液循环渗透进入肿瘤。肿瘤微环境对人体抗肿瘤免疫具有抑制作用,可以为癌细胞内微生物群提供避难所。越来越多的证据表明,癌细胞内微生物群可以降低化疗效果,增强药物对正常组织的毒性,并且促进癌细胞的促炎反应和增殖。通过调节肠道微生物群,虽然已经对增强抗癌疗效和免疫反应取得重大进展,但是清除肿瘤微环境细菌对于抗癌的影响尚不明确。
清除癌细胞内微生物群主要依靠抗生素全身用药,由于缺乏靶向性,全身用药可能引起一系列负面影响,包括肠道益生菌缺乏、体内平衡破坏、疾病易感性、细菌耐药性等,尤其对于恶性肿瘤患者。此外,抗生素可能降低免疫检查点抑制剂抗癌治疗的有效性,并且严重降低化疗效果。因此,癌细胞内微生物群靶向抗菌虽然是学者们所希望的,但是尚未实现。
除了短期抑制率之外,最终的抗癌目标是长期无复发生存,这需要针对复发的持久免疫记忆以及针对癌症转移的全身免疫反应。近年来研发的各种疗法,例如化学动力学疗法以及光热疗法,已经带来显著的短期疗效。虽然如此,肿瘤微环境残留癌细胞或突变细胞仍然可能导致肿瘤复发高风险。为了提高无复发生存率,有学者提出将这些抗癌疗法联合免疫刺激药物(例如免疫调节剂、免疫检查点抑制剂、抗原等)激活人体免疫。癌细胞内微生物群靶向抗菌联合抗癌治疗尚无先例,抗癌疗效以及免疫系统如何应对该联合仍是悬而未决的问题。
2024年5月17日,英国《自然》旗下《自然通讯》在线发表哈尔滨工业大学的研究报告,通过将癌细胞内微生物群靶向抗菌药物联合抗癌治疗,而且不采用抗生素,可以解决被癌细胞内微生物群感染的癌症抑制免疫以及过度生长,实现长期无复发生存超过700天。
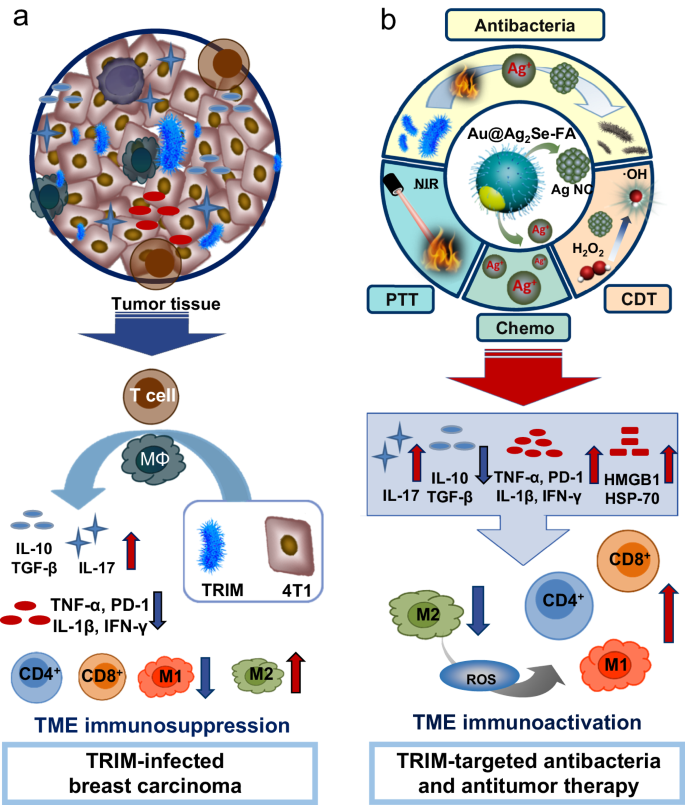
该研究考虑到乳腺癌发病率和死亡率较高,其中三阴性乳腺癌雌激素受体、孕激素受体、人类表皮生长因子受体HER2均为阴性,对内分泌治疗和HER2靶向治疗通常无效,以及目前已知乳腺微生物群丰富而且多样,故首先选择小鼠三阴性乳腺癌4T1细胞建立动物模型进行研究。大肠杆菌在恶性和正常乳腺细胞中较丰富,被用于构建癌细胞内微生物群模型。
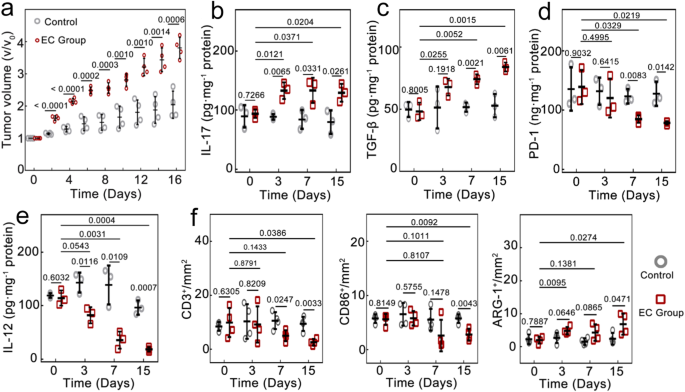
该研究证实,癌细胞内微生物群可以提高免疫抑制细胞因子(白细胞介素IL-10、转化生长因子TGF-β)和促炎细胞因子(白细胞介素IL-17)表达水平,同时降低促炎细胞因子(包括白细胞介素IL-12、肿瘤坏死因子TNF-α、干扰素IFN-γ)和免疫细胞程序性死亡蛋白PD-1的表达。癌细胞内微生物群还可减少T淋巴细胞以及M1样肿瘤相关巨噬细胞的数量,同时增加M2样肿瘤相关巨噬细胞的数量,肿瘤微环境免疫抑制被加强,肿瘤生长加速。
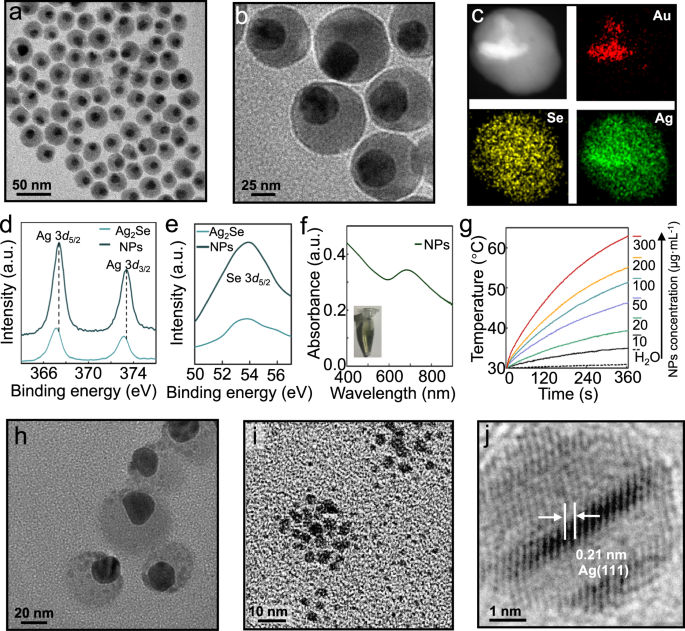
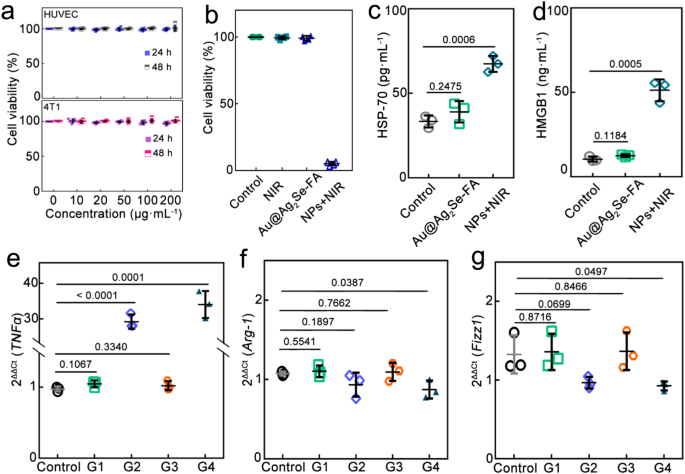
为了能够通过单一药物同时进行抗菌和抗癌治疗,该研究设计出表面经过叶酸修饰并且被硒化银覆盖的纳米金颗粒,可以释放银离子和类芬顿反应产生强大的抗菌作用,与化疗和化学动力学疗法一起抑制癌细胞内微生物群和癌细胞,促进M2恢复为M1样肿瘤相关巨噬细胞。光热疗法通过近红外光照射产生高温清除癌细胞,在肿瘤微环境中释放热休克蛋白HSP70,激活强烈的免疫反应。这种抗菌联合抗癌治疗的免疫调节作用,对于被癌细胞内微生物群感染的小鼠和在非无菌环境中饲养的小鼠都有效,二次接种和远处肿瘤研究证实存在持久的免疫记忆和全身免疫反应。
结果,乳腺肿瘤被治愈,至少700天未复发。该研究还利用小鼠前列腺癌RM-1细胞建立第二种癌症模型,证明该方法普遍性。
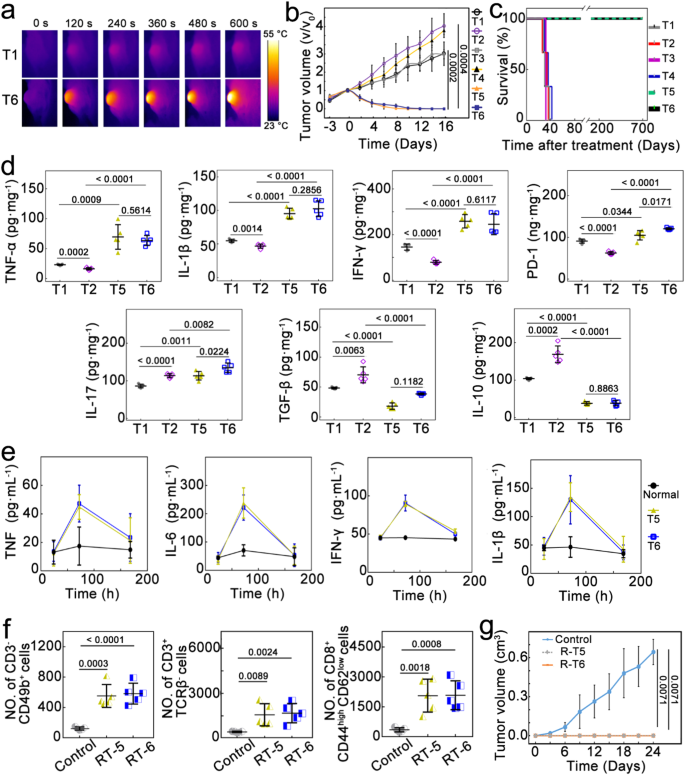
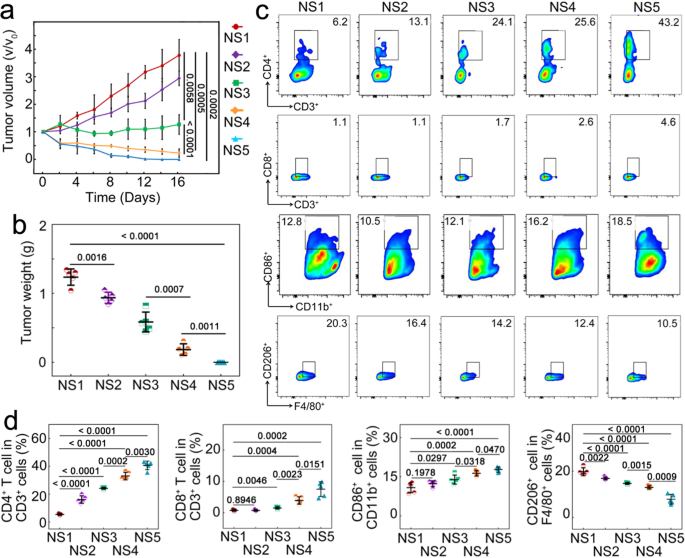
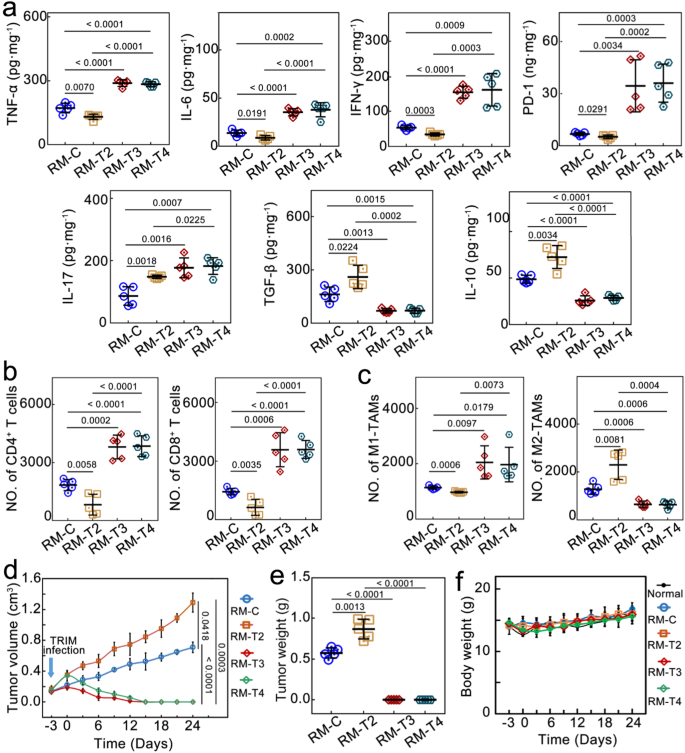
因此,该研究结果表明,将癌细胞内微生物群靶向抗菌药物联合抗癌治疗,对于肿瘤微环境免疫抑制以及免疫调节具有重要意义,故有必要进一步开展临床研究进行验证。
Nat Commun. 2024 May 17;15(1):4194. IF: 16.6
Long-term relapse-free survival enabled by integrating targeted antibacteria in antitumor treatment.
Wang Y, Han Y, Yang C, Bai T, Zhang C, Wang Z, Sun Y, Hu Y, Besenbacher F, Chen C, Yu M.
Harbin Institute of Technology, Harbin, China; Aarhus University, Aarhus, Denmark; National Center for Nanoscience and Technology, Chinese Academy of Sciences, Beijing, China.
The role of tumor-resident intracellular microbiota (TRIM) in carcinogenesis has sparked enormous interest. Nevertheless, the impact of TRIM-targeted antibacteria on tumor inhibition and immune regulation in the tumor microenvironment (TME) remains unexplored. Herein, we report long-term relapse-free survival by coordinating antibacteria with antitumor treatment, addressing the aggravated immunosuppression and tumor overgrowth induced by TRIM using breast and prostate cancer models. Combining Ag+ release with a Fenton-like reaction and photothermal conversion, simultaneous bacteria killing and multimodal antitumor therapy are enabled by a single agent. Free of immune-stimulating drugs, the agent restores antitumor immune surveillance and activates immunological responses. Secondary inoculation and distal tumor analysis confirm lasting immunological memory and systemic immune responses. A relapse-free survival of >700 days is achieved. This work unravels the crucial role of TRIM-targeted antibacteria in tumor inhibition and unlocks an unconventional route for immune regulation in TME and a complete cure for cancer.
PMID: 38760364
DOI: 10.1038/s41467-024-48662-x
文献共享

(来源:SIBCS)
声 明
凡署名原创的文章版权属《肿瘤瞭望》所有,欢迎分享、转载。本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。

|
|