|
|
作者:中国医学论坛报今日肿瘤
2024年4月26日~27日,新一届中国临床肿瘤学会 (CSCO) 指南会于山东济南成功召开,大会对包括肺癌在内多个瘤种的CSCO指南内容更新进行发布和解读。在2024年《CSCO非小细胞肺癌(NSCLC)诊疗指南》(以下简称“指南”) 中,专家组纳入了抗体偶联药物 (ADC) 在NSCLC领域的最新进展,其主要集中在对HER2突变晚期NSCLC的后线治疗:靶向HER2的ADC德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗)由三级推荐上调为二级推荐;此外,TROP2作为NSCLC的重要靶点,靶向 TROP2的ADC德达博妥单抗 (Dato-DXd/DS-1062) 首次被写入Ⅳ期无驱动基因非鳞状NSCLC二线治疗的文字注释部分[1]。
在CSCO指南会落下帷幕、尘埃落定之际,本报特邀同济大学附属上海市肺科医院任胜祥教授围绕指南中ADC的更新内容带来精彩解读,展望ADC未来应用之路,指导我国晚期肺癌的临床实践。
专家简历

任胜祥 教授
主任医师、教授、博士生导师
同济大学附属上海市肺科医院肿瘤科行政主任
IASLC教育委员会委员
中国医促会胸部肿瘤分会秘书长
中国抗癌协会肿瘤药物临床研究专委会青委会副主委
上海市医师协会肿瘤分会副主委
上海市抗癌协会肺癌分子靶向免疫治疗委员会副主委
上海市抗癌协会转化研究委员会副主委
上海市医学会肿瘤靶分子专科分会青委会副主委
CSCO非小细胞肺癌委员会常务委员
CSCO青年委员会常务委员
CSCO免疫专家委员会常务委员
CSCO老年肿瘤防治专家委员会委员
中国老年病协会肿瘤专业委员会常务委员
上海市抗癌协会肿瘤呼吸内镜学专业委员会常务委员
ADC用于NSCLC领域方兴未艾
新版CSCO指南实时更新ADC探索进展
作为抗肿瘤治疗领域冉冉升起的“新星”,ADC在多个实体瘤领域取得重要突破,并在乳腺癌等瘤种领域以相应适应证成功获批上市。在NSCLC领域,ADC的探索同样突破不断,针对HER2、TROP2、HER3、MET等靶点的ADC药物在NSCLC领域得到积极研发,尤其是HER2 ADC和TROP2 ADC已经取得显著成绩,越来越受到广泛关注。
HER2突变在NSCLC患者中的突变率约2%~4%[2],虽然突变率并不高,但中国肺癌人群基数巨大,伴随HER2突变的NSCLC患者仍存未被满足的治疗需求。由于乳腺癌领域取得显著治疗效果的抗HER2治疗如曲妥珠单抗、曲妥珠单抗+帕妥珠单抗等并未在NSCLC领域带来突破,CSCO指南对晚期HER2突变NSCLC的治疗仍建议参考Ⅳ期无驱动基因NSCLC治疗的推荐部分,然而临床常见的化疗方案和免疫治疗在HER2突变晚期NSCLC患者中的疗效并不佳,且新型小分子酪氨酸激酶抑制剂 (TKI) 药物治疗该类患者的整体疗效和安全性也不尽如人意。面对亟待解决的治疗困境,靶向HER2的ADC成为该类患者的新希望。
德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 是率先在NSCLC领域表现出令人鼓舞的抗肿瘤活性的抗HER2 ADC。基于DESTINY-Lung01和DESTINY-Lung02研究[3-4],该药成为全球首个获美国食品药品监督管理局 (FDA) 批准用于治疗既往经治HER2突变不可切除或转移性NSCLC的ADC。基于DESTINY-Lung02研究更长随访结果的不断公布[5],2024年指南将德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 治疗晚期HER2突变阳性NSCLC患者后线治疗的推荐等级由三级推荐提升至二级推荐[1] (图1),充分展现了其在NSCLC领域的良好治疗前景。
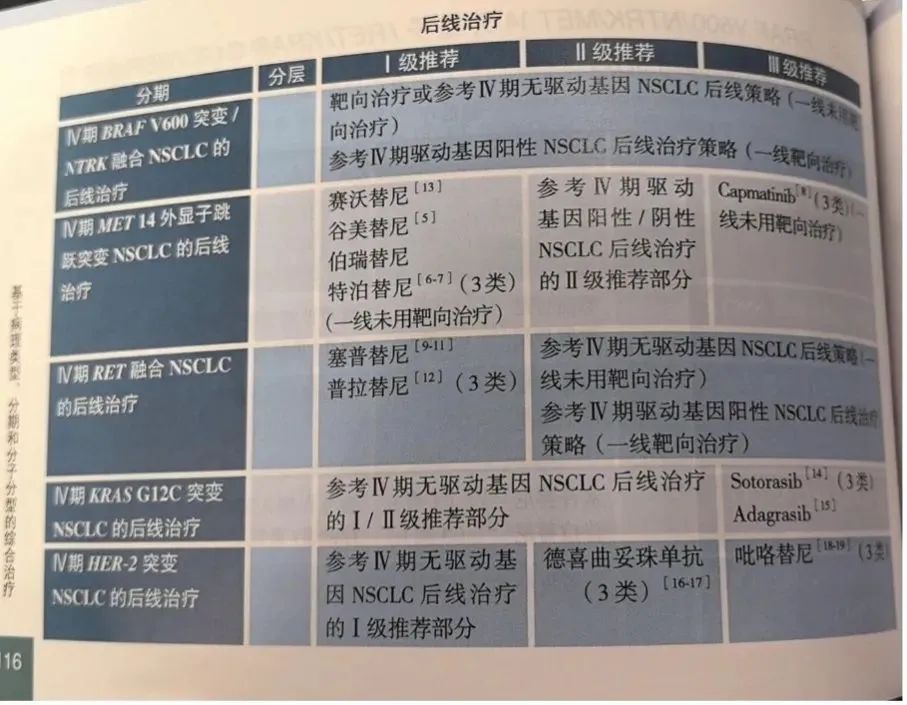
图1.《CSCO NSCLC诊疗指南 (2024) 》
与此同时,靶向TROP2的ADC的研发同样前景可期。数据显示,TROP2在64%~75%的NSCLC患者存在TROP2高表达,且TROP2高表达与患者生存期缩短及不良预后密切相关[6]。基于TROPION-Lung01研究中TROP2 ADC德达博妥单抗 (Dato-DXd/DS-1062) 在靶向和免疫治疗经治晚期非鳞NSCLC患者中表现出的生存改善和可控的安全性[7-8],新版指南将德达博妥单抗 (Dato-DXd/DS-1062) 以注释形式写入Ⅳ期无驱动基因非鳞状NSCLC后线治疗[1] (图2)。

图2.《CSCO NSCLC诊疗指南 (2024) 》
至此,德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 与德达博妥单抗 (Dato-DXd/DS-1062) 分别以各自靶点为“支点”,初步构建了NSCLC领域ADC应用矩阵的“蓝图”。
破局之作
抗HER2 ADC携高级别循证
验证其显著疗效和良好安全性
德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 是一种结构优化的靶向HER2的ADC,其在NSCLC领域的疗效、安全性及最佳剂量逐步通过DS8201-A-J101首次人体试验[9]、DESTINY-Lung01研究、DESTINY-Lung02、DESTINY-Lung05[3-5]研究得到验证。
DESTINY-Lung02研究纳入152例既往接受过至少一种全身治疗方案 (包括含铂化疗) 的晚期HER2突变NSCLC患者。患者以2:1的比例随机分配至德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 5.4mg/kg组或6.4mg/kg组,每3周给药一次。研究主要终点为通过盲态独立中心审查 (BICR) 评估确认的客观缓解率 (ORR),次要终点为研究者及BICR评估的疾病控制率 (DCR)、缓解持续时间 (DoR)、无进展生存期 (PFS)、总生存期 (OS) 和安全性。
2023年世界肺癌大会 (WCLC) 公布的最新全人群结果显示,德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 在5.4mg/kg剂量组和6.4mg/kg剂量组均展现出良好的抗肿瘤活性和生存获益。2023年欧洲肿瘤内科学会亚洲年会 (ESMO Asia) 公布的亚洲人群结果显示,亚洲人群与全球人群获益趋势一致,5.4mg/kg和6.4mg/kg剂量组确认的ORR分别为50.8%和73.3%,中位DoR为16.8个月和未达到,中位PFS分别为10.8个月和15.4个月,中位OS分别为19.5个月和未达到 (图3)。
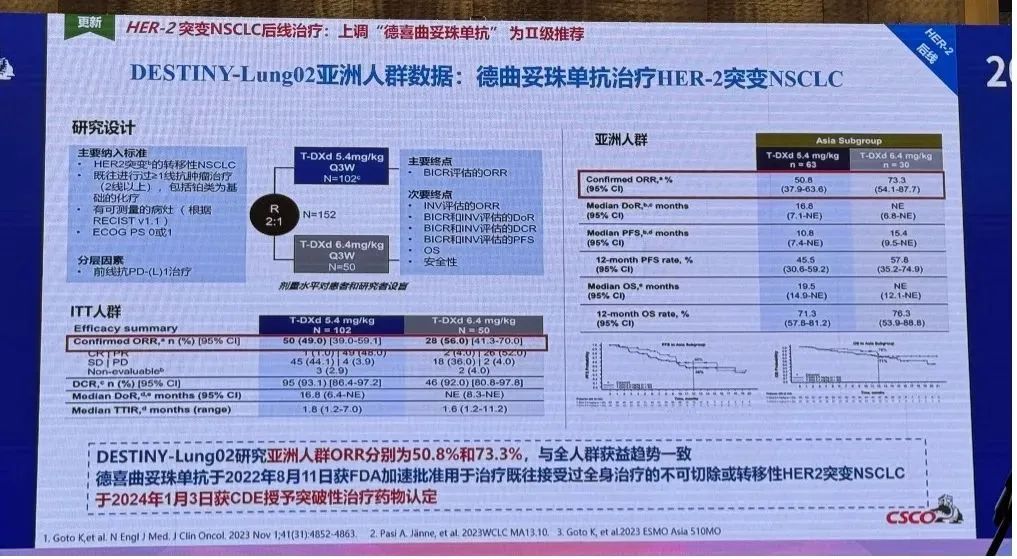
图3.DESTINY-Lung02亚洲人群数据
安全性数据显示,5.4mg/kg剂量组在治疗期间≥3级药物相关不良事件 (TEAEs),TEAEs导致停药、减量、中断治疗以及药物相关间质性肺病 (ILD) 发生率方面均低于6.4mg/kg剂量组。同时,亚洲患者中无≥3级药物相关ILD发生,提示5.4mg/kg剂量组安全性良好。
DESTINY-Lung02研究长期随访数据为德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 在2024年版指南中推荐等级的提升提供了有力依据,但鉴于该研究并未纳入中国患者,因此聚焦于中国人群的Ⅱ期DESTINY-Lung05研究展开探索[5]。DESTINY-Lung05研究旨在评估5.4mg/kg的德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 在接受≥1次抗肿瘤治疗 (无HER2定向治疗) 后疾病进展、携带HER2 19/20号外显子突变的转移性非鳞状NSCLC中国患者的疗效和安全性。主要终点为独立中心审查 (ICR) 评估的ORR,次要终点包括研究者评估的ORR,以及研究者和ICR评估的DCR、DoR、PFS、OS和安全性等 (图4)。

图4.DESTINY-Lung05研究设计
2024年美国癌症研究学会 (AACR) 公布的结果显示[10],截至2023年9月23日,中位随访时间为9.8个月,72名HER2突变NSCLC患者接受5.4 mg/kg德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 治疗。主要研究终点方面,由ICR评估确认的ORR为58.3%,41位患者获得部分缓解 (PR),1位患者更是获得完全缓解 (CR)(图5),中位DoR未达到,DCR为91.7%,中位PFS未达到,12个月PFS率为55.1%。由独立中心审查和研究者评估确认的ORR均为58.3%,研究者评估确认的中位DoR为9个月,DCR为93.1%,中位PFS为10.8个月。

图5.DESTINY-Lung05研究由ICR评估患者的最佳缓解
安全性数据显示,5.4 mg/kg德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 用于中国患者安全性良好,因药物相关不良事件停药比例仅为2.8%,药物相关ILD发生率为9.7%,且多为1~2级。
DESTINY-Lung05研究为德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 5.4 mg/kg用于中国经治NSCLC患者提供了有力循证,为该药在新版指南中推荐等级的提升提供了补充依据,同时也为其在中国的获批和应用奠定了循证基础。
鉴于德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 在NSCLC抗HER2治疗领域的优异表现,2024年1月3日,国家药品监督管理局药品审评中心 (CDE) 授予其突破性治疗药物认定,拟定适应证为: 治疗肿瘤存在激活HER2 (ERBB2) 突变且既往接受过至少一种系统治疗的不可切除或转移性NSCLC成人患者。目前,该药已纳入中国上市优先评审程序,中国HER2突变晚期NSCLC患者有望迎来兼具疗效和安全性的新选择。
值得一提的是,德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 在肺癌领域的探索从未止步,向更前线进军的同时,积极开展ADC联合治疗的探索研究。其中,Ⅲ期DESTINY-Lung04研究是评估其对比帕博利珠单抗+化疗一线治疗HER2外显子19或20突变不可切除的局部晚期或转移性NSCLC患者疗效和安全性。DESTINY-Lung03研究则正在积极探索其联合度伐利尤单抗、铂类/培美曲塞治疗HER2过表达晚期或转移性非鳞状NSCLC患者的疗效。另有Ⅰ期临床研究 (NCT04042701) 则探索其联合帕博利珠单抗在HER2过表达及HER2突变NSCLC患者队列中的疗效和安全性。可以看到,德曲妥珠单抗 (DS-8201/T-DXd,曾用名德喜曲妥珠单抗) 正在夯实其肺癌领域HER2 ADC引领者的身份,并逐步扩大获益人群。
榜上有名
靶向TROP2 ADC治疗NSCLC
循证数据优秀、前景广阔
在新版指南更新中,除靶向HER2的ADC治疗地位得到提升,靶向TROP2的ADC德达博妥单抗 (Dato-DXd/DS-1062) 凭TROPION-Lung01研究数据以注释的形式首次写入指南 (图6)。
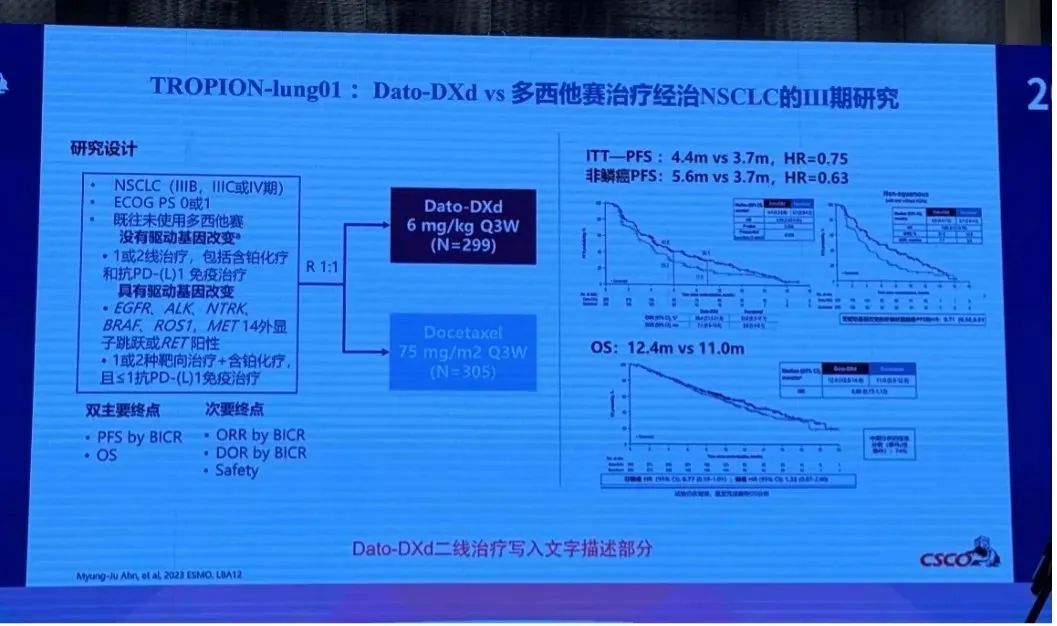
图6.TROPION-Lung01研究数据
TROPION-Lung01研究是一项全球性、随机、多中心、开放标签的Ⅲ期临床试验,旨在评估德达博妥单抗 (Dato-DXd/DS-1062) 对比多西他赛在既往至少接受过一次治疗、伴或不伴有可靶向AGA的局部晚期或转移性NSCLC患者的有效性和安全性[7-8]。主要终点为BICR评估的PFS和OS。2024年欧洲肺癌大会 (ELCC) 上公布TROPION-Lung01研究针对非鳞非小细胞肺癌 (NSQ-NSCLC) 亚组分析的最新数据:德达博妥单抗 (Dato-DXd/DS-1062) 组的中位PFS达5.5个月,较多西他赛组提升近2月,降低疾病进展或死亡风险37% (HR=0.63,95%CI: 0.51-0.79),其与多西他赛组的6个月PFS率分别为46.6%和28.2%。目前,NSQ-NSCLC人群的OS数据尚未成熟,但德达博妥单抗 (Dato-DXd/DS-1062) 组已展现出可观的获益趋势,其中位OS为13.4个月,较多西他赛组延长2月,降低疾病死亡风险21% (HR=0.79,95%CI: 0.60-1.02)。
抗肿瘤活性方面,德达博妥单抗 (Dato-DXd/DS-1062) 组显示了更显著的ORR,达31%,较多西他赛组提升18%。在德达博妥单抗 (Dato-DXd/DS-1062) 组中,69例患者获得PR,4例患者更是获得CR,而多西他赛组未有CR患者。同时,德达博妥单抗 (Dato-DXd/DS-1062) 组较多西他赛组在DoR (7.7个月 vs 5.6个月) 和DCR (80% vs 61%) 方面均有令人鼓舞的抗肿瘤活性。在对NSQ-NSCLC人群年龄、性别、种族,是否吸烟,是否有脑转移,是否伴AGA亚组分析中,德达博妥单抗 (Dato-DXd/DS-1062) 组亦表现出获益更优的趋势,其中,伴AGA较不伴AGA的NSQ-NSCLC患者获益更为显著。安全性结果分析显示,德达博妥单抗 (Dato-DXd/DS-1062) 组在≥3级TRAEs、因TRAEs需要减少剂量以及因TRAEs停止治疗发生率方面较多西他赛组更低。基于此,TROPION-Lung01研究中德达博妥单抗 (Dato-DXd/DS-1062) 凭借优秀的疗效和安全性表现,成功写入新版指南Ⅳ期无驱动基因非鳞状NSCLC后线治疗的文字注释部分。
与其他表现出巨大潜力的创新药物一样,德达博妥单抗 (Dato-DXd/DS-1062) 正通过一系列研究在NSCLC领域开展更多探索。例如,TROPION-Lung07、TROPION-Lung08及AVANZAR研究正在探索德达博妥单抗 (Dato-DXd/DS-1062) 联合免疫治疗在初治驱动基因阴性NSCLC人群中的获益。期待未来更多研究数据的进一步公布,为晚期肺癌患者的临床实践提供更丰富的循证医学证据,助力优化治疗策略,使更广泛的患者群体能从疗效和安全性兼优的新型抗肿瘤药物中获得生存改善,提高生活质量,推动“健康中国2030”美好蓝图早日实现。
参考文献:
1.《CSCO非小细胞肺癌诊疗指南 (2024) 》.
2.Ren S,et al. ESMO Open. 2022 Feb;7(1):100395.
3.Li BT, et al. 2022ESMO. 976P.
4.Goto K, et al. .J Clin Oncol. 2023 Nov 1;41(31):4852-4863.
5.Goto K, et al. 2023 ESMO Asia 510MO.
6.Liu X, et al. Pharmacol Ther, 2022,239:108296.
7.M-J. Ahn, et al. 2023 ESMO: LBA12.
8.https://cslide.ctimeetingtech.com/elcc24hybrid/attendee/confcal_1/presentation/list?q=59p
9.Tsurutani J, et al. Cancer Discov. 2020 May;10(5):688-701.
10.Y. Cheng,et al. 2024 AACR. CT248. |
|