|
|
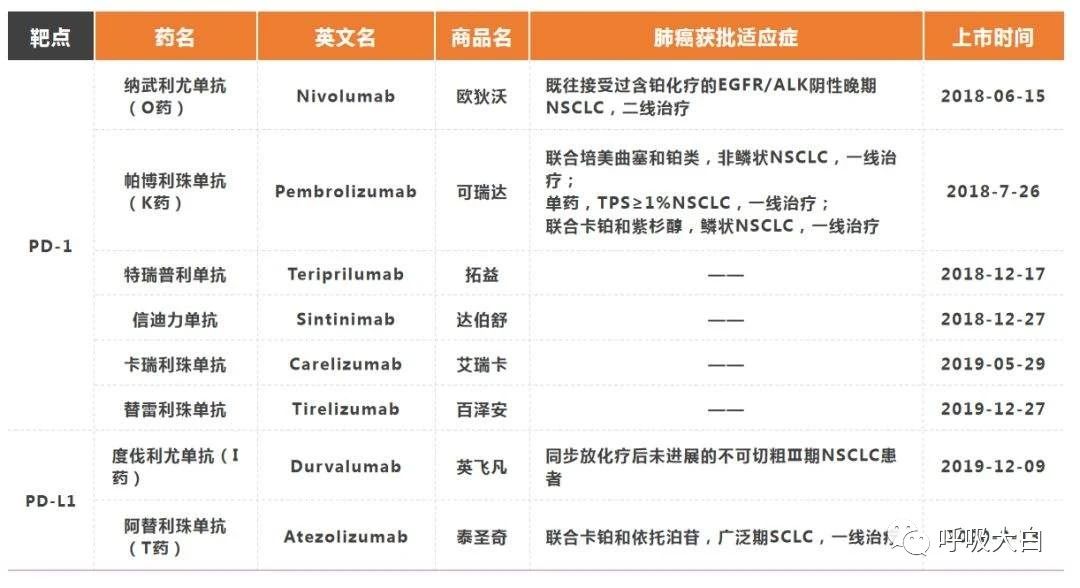
以免疫检查点抑制 剂(ICIs)为代表的免疫治疗,给肺癌治疗带来了新的希望。ICIs是针对机体免疫检查点的单克隆抗体,可以阻断T细胞负性共刺激信号通路,恢复机体的抗肿瘤免疫应答,促进T细胞对肿瘤细胞的清除。常见的 ICIs 有程序性死亡受体 1(PD ⁃ 1)抑制剂纳武单抗Nivolumab和派姆单抗Pembrolizumab、程序性死亡配体1(PD⁃L1)抑制剂阿特珠单抗Atezolizumab和德瓦鲁单抗Durvalumab及细胞毒T细胞抗原 4(CTLA ⁃ 4)抑制剂伊匹木单抗 Ipilimumab和曲美木单抗Tremelimumab。
试验结果显示,非小细胞肺癌(NSCLC)的 ICIs 一线单药治疗的客观缓解率(ORR)为27.2%~44.8%,中位无进展生存期(PFS)为5.4~10.3个月,中位总生存期(OS)为16.4~30.0个月;ICIs二线单药治疗的ORR为14%~20%,中位PFS为2.3~5.2个月,中位OS为9.2~15.8个月。目前Nivolumab、Pembrolizumab、Durvalumab以及Atezolizumb已经获得美国食品药品监督管理局批准用于治疗肺癌。2018年6月我国国家药品监督管理局批准Nivolumab用于治疗标准化疗方案失败的晚期NSCLC患者,2019年3月又批准Pembrolizumab与培美曲塞和铂类联合用于表皮生长因子受体(EGFR)或间变性淋巴瘤激酶(ALK)突变阴性的转移性非鳞 NSCLC 患者的一线治疗。
多项大型临床试验报道irAE的发生率为60%~80%。免疫联合治疗与免疫单药治疗相比irAE的发生率升高。irAE可发生于任何器官和组织,主要累及皮肤、胃肠道、内分泌器官、肝脏和肺等。irAE多为轻度至中度,但也会出现一些严重的不良反应,如免疫相关性肺炎、免疫间质性肾炎及免疫相关性心肌炎等,有时会危及患者的生命。
ICIs相关肺炎(CIP)是一种由ICIs引起的临床、影像和病理表现各异的肺损伤,是引起 ICIs 相关死亡的重要原因之一。CIP 常见于PD⁃1或PD⁃L1抑制剂治疗,在CTLA⁃4抑制剂治疗时也有发生。致死性CIP的发生率均高于其他的发生率为 0.2%~0.5%,CIP 是免疫治疗相关死亡的独立危险因素。CIP缺乏典型的临床症状及影像学表现,且尚无统一的诊断标准及流程,如果处理不当可能危及患者的生命,需引起临床医生的关注与重视。
一、CIP的流行病学
多项临床试验结果显示,ICIs 单药治疗时CIP的发生率<5%。PD⁃1抑制剂与PD⁃L1抑制剂相比,前者CIP的发生率较高(3.6%,1.3%)且重度CIP发生率高(1.1%,0.4%)。
CIP的发病时间从第1次使用ICIs后数小时至24个月不等,中位发病时间为2~3个月,CIP的发病时间可能晚于大多数免疫相关不良反应,PD⁃1抑制剂与 CTLA⁃4 抑制剂联合治疗时 CIP 的发病时间有提前的趋势。重度 CIP一般常发生于免疫治疗开始后 6 个月,但鉴于免疫反应的滞后性和持续性,CIP 可发生在免疫治疗中的任何时间,故全程进行严密的监测和随访至关重要。
二、CIP的危险因素
与ICIs单药治疗相比,免疫联合治疗(如双免疫联合治疗、免疫联合化疗、免疫联合放疗、免疫联合分子靶向药物治疗)可增加发生 CIP 的风险。
多项回顾性分析结果提示,高龄(年龄≥70岁)、亚洲人群、有烟草暴露史、有肺部基础疾病、基线肺功能受损及多线治疗等可能与CIP的发生有关。CIP 高危因素的识别能够辅助筛选高危患者,早期诊断 CIP,及时治疗并进行密切监测,避免严重后果。
三、CIP的临床表现
CIP缺乏典型临床症状,1/3的患者发病时可无症状。通常CIP可表现为新发或加重的呼吸困难、咳嗽、胸痛、发热及乏力等。在接受 PD⁃1 和PD⁃L1抑制剂治疗的回顾性研究中,CIP最常见的临床症状是呼吸困难(53%)与咳嗽(15%)。文献报道CTLA⁃4抑制剂治疗时可发生急性间质性肺炎或弥漫性肺泡损伤等危及生命的呼吸系统不良事件,需引起临床医生的关注。CIP常见的体征缺乏特异性,可出现呼吸频率增快、口唇发绀、肺部可闻及湿性啰音或Velcro 啰音等。对既往存在肺部基础疾病(如慢阻肺或肺纤维化)的肺癌患者,在免疫治疗过程中如出现原有呼吸系统症状及体征加重,需警惕CIP的可能性。
四、CIP的影像和实验室检查
对所有新发的呼吸系统症状(如呼吸困难、咳嗽、胸痛等)均应谨慎评估,建议完善肺部影像学检查。肺部CT比X线胸片可以更好地识别CIP,推荐其作为首选的影像学检查方法。CIP 的影像学表现多样,可表现为双肺野散在或弥漫性磨玻璃影、斑片状实变影、小叶间隔增厚、网格影、牵拉性支气管扩张及纤维条索影等。除典型肺炎表现外,免疫相关性肺损伤可引起胸腔积液和肺结节病样肉芽肿性反应,应引起临床医生的关注与重视。
怀疑发生 CIP 时需进行血常规、血生化、电解质、ESR及感染相关检查,推荐常规进行动脉血气检查(或血氧饱和度监测),如患者一般状态尚可,建议行肺功能检查,应包括反映肺通气、容量及弥散功能的指标,如第一秒用力呼气容积(FEV1)、用力肺活量(FVC)、肺总量(TLC)及一氧化碳弥散量(DLCO)等。DLCO 降低及限制性通气功能障碍是CIP常见的肺功能异常改变。
当CIP与肺部感染、肺癌进展及其他相关疾病鉴别诊断困难时,可结合支气管镜检查或肺穿刺活检进一步确认。一项回顾性研究结果显示,67.4%的CIP患者的支气管肺泡灌洗液中细胞总数升高,以淋巴细胞增多为主,CD4/CD8比例明显倒置。CIP没有单一特征性病理学表现,可表现为机化性肺炎、弥漫性肺泡损伤、嗜酸粒细胞肺炎或以淋巴细胞浸润为主的间质性肺炎等。
五、CIP的诊断与鉴别诊断
(一)诊断标准
1. ICIs用药史。
2.新出现的肺部阴影(如磨玻璃影、斑片实变影、小叶间隔增厚、网格影、牵拉性支气管扩张及纤维条索影等)。
3. 除外肺部感染、肺部肿瘤进展、其他原因引起的肺间质性疾病、肺血管炎、肺栓塞及肺水肿等。
同时符合以上3条即可诊断为CIP。
如果符合以下条件可进一步支持CIP的诊断:新发或加重的呼吸困难、咳嗽、胸痛、发热及乏力等;动脉血气分析提示低氧血症,肺功能检查提示DLCO降低,限制性通气功能障碍;诊断不明时可进行活检,活检方式包括支气管镜下活检、CT引导下肺穿刺活检或胸腔镜下肺活检,活检方式的选择取决于病灶的位置和分布及患者的一般状况,进行活检前需要进行风险获益评估。
(二)CIP的鉴别诊断
当CIP临床症状与影像学分级不一致时,以两者中较高级别为CIP严重程度等级。
七、CIP的分级治疗
(一)轻度CIP(1级)
1.应酌情推迟 ICIs治疗。
2.对症支持治疗。
3.密切随诊,观察患者病情变化,监测症状、体征及血氧饱和度;检测血常规、血生化、感染指标、动脉血气及肺功能等指标;如果症状加重及时行胸部CT检查。如病情进展可按更高级别处理。
4.如果不能排除合并感染,建议加用抗感染治疗。
5.患者症状缓解且肺部影像学检查证实病情痊愈,可考虑重新使用ICIs治疗。
(二)中度CIP(2级)
(三)重度CIP(≥3级)
1.可考虑永久性停用ICIs。
2.住院治疗,如病情需要可入住ICU。
3.积极进行氧疗,保证氧合状态。必要时使用呼吸机辅助通气或体外膜肺氧合治疗。
4.对症支持及生命支持治疗。
5.激素治疗:静脉给予中至大剂量激素,如甲泼尼龙2~4 mg·kg-1·d-1或等效药物;激素治疗至症状及影像学改善后逐渐减量,疗程>8周。
6.大剂量激素治疗期间可预防性使用质子泵抑制剂及补充钙剂。
7.密切观察病情变化:每天观察症状和体征,监测血氧饱和度、血压及血糖水平、血常规、血生化、感染指标、凝血指标及动脉血气;48~72 h后行床旁X线胸片,如果病情允许可行胸部CT检查。
8. 如果病情进展可考虑加用免疫球蛋白和(或)免疫抑制剂治疗。
9.如果不能排除合并感染,建议加用抗感染治疗。
目前关于 CIP 治疗中激素以及免疫抑制剂的剂量与疗程尚缺乏大规模研究结果证实,应根据患者的基础疾病、合并症、不良反应严重程度及激素耐受情况进行个体化治疗,以降低产生潜在并发症的风险。
|
|