【背景】
曲妥珠单抗德鲁司坦(T-DXd)5.4和6.4 mg/kg在多种癌症适应症中显示出强大的抗肿瘤活性;然而,T-DXd 5.4 mg/kg尚未在既往接受过治疗的人表皮生长因子受体2突变型(HER2m,定义为单核苷酸变异和外显子20插入)转移性非小细胞肺癌(mNSCLC)患者中进行评估。
【方法】
研究设计:
国际多中心、双盲、双臂、随机II期。首次在既往接受过治疗(含铂疗法)的HER2m mNSCLC患者中研究了T-DXd 5.4 mg/kg,每3周一次,并进一步评估了T-DXd 6.4 mg/kg,每3周一次。评估T-DXd治疗HER2突变的转移性或不可切除的NSCLC的疗效和安全性。

图3. DESTINY-Lung02的研究设计
研究对象:
在既往接受过治疗(含铂疗法)的HER2m mNSCLC患者
干预措施:
T-DXd 5.4 mg/kg,每3周一次,并进一步评估了T-DXd 6.4 mg/kg,每3周一次。
研究终点:
主要终点是通过盲法独立中央审查确认的 RECIST v1.1 客观反应率 (ORR)。
【结果】
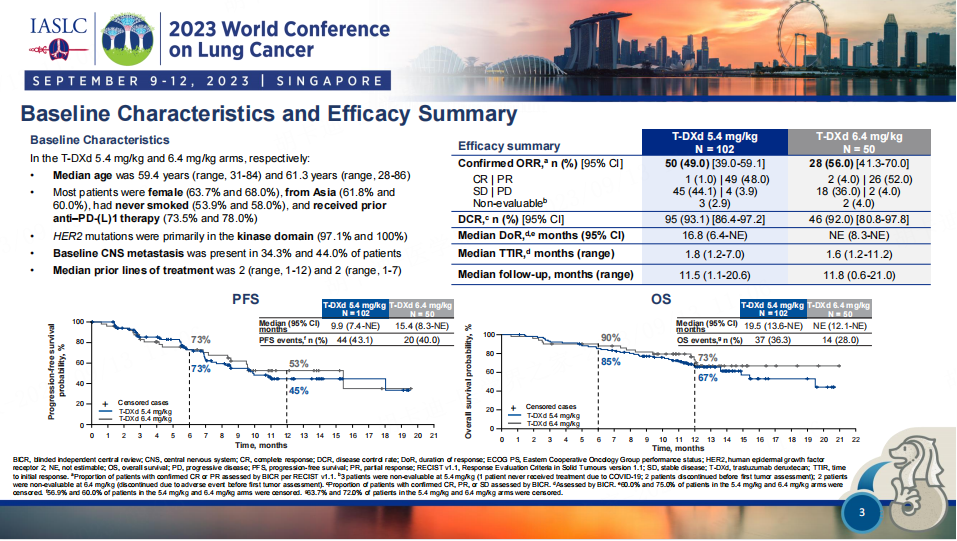
图4. DESTINY-Lung02研究的患者基线特征和疗效数据
生存:
152名患者以2:1的比例随机分配到T-DXd 5.4或6.4 mg/kg,每3周一次。截至2022年12月23日,5.4 mg/kg的中位随访时间为11.5个月(范围为1.1-20.6),6.4 mg/kg的中位随访时间为11.8个月(范围为0.6-21.0)。5.4和6.4 mg/kg的确证ORR分别为49.0%(95% CI,39.0至59.1)和56.0%(95% CI,41.3至70.0),中位应答持续时间分别为16.8个月(95% CI,6.4至不可估计[NE])和NE(95% CI,8.3至NE)。5.4毫克/千克的中位治疗时间为7.7个月(范围为0.7-20.8),6.4毫克/千克的中位治疗时间为8.3个月(范围为0.7-20.3)。
T-DXd治疗HER2突变NSCLC的ORR为55%,中位DoR为9.3个月,中位PFS为8.2个月,中位OS为17.2个月。
截至2022年12月23日,分别有102例和50例患者被随机分配至5.4 mg/kg组和6.4 mg/kg组,中位随访时间分别为11.5个月和11.8个月;BICR评估的cORR分别为49.0%和56.0%;BICR评估的mPFS分别为9.9个月和15.4个月;mOS分别为19.5个月和NE。
DESTINY-Lung02 研究共纳入 152 例既往接受过一种系统性治疗的不可切除或转移性 HER2 突变 NSCLC 患者,其中德曲妥珠单抗 5.4 mg/kg 组纳入 102 例患者,6.4 mg/kg 组纳入了 50 例患者。5.4 mg/kg 组的中位随访时间为 11.5 个月(1.1-20.6 个月),6.4 mg/kg 组为 11.8 个月(0.6-21.0 个月)。两组 BICR 的临床客观缓解率(cORR)分别为 49.0%(95%CI:39.0%-59.1%)和 56.0%(95%CI:41.3%-70.0%),BICR 的中位持续缓解时间(DoR)分别为 16.8 个月(95%CI:6.4 个月-NE) 和 NE(95%CI:8.3 个月-NE),BICR 的中位 PFS 分别为 9.9 个月(95%CI:7.4 个月-NE)和 15.4 个月(95%CI:8.3 个月-NE)。
安全性:
使用5.4和6.4 mg/kg的101名患者中分别有39名(38.6%)和50名患者中分别有29名(58.0%)发生了≥3级的药物相关治疗突发不良事件。101名患者中有13名(12.9%)和50名患者中有14名(28.0%)在使用5.4和6.4毫克/千克药物时出现了经判定与药物相关的间质性肺病(每侧均有2.0%的患者≥3级)。
安全性方面,5.4mg/kg组和6.4mg/kg组≥3级治疗相关不良事件发生率分别为38.6%和58.0%,最常见≥3级不良事件包括中性粒细胞减少(18.8%和36.0%)和贫血(10.9%和16.0%);间质性肺疾病(ILD)/非感染性肺炎的发生率分别为12.9%和28.0%。相比6.4mg/kg组,5.4mg/kg组观察到更优的安全性和更低的ILD发生率。
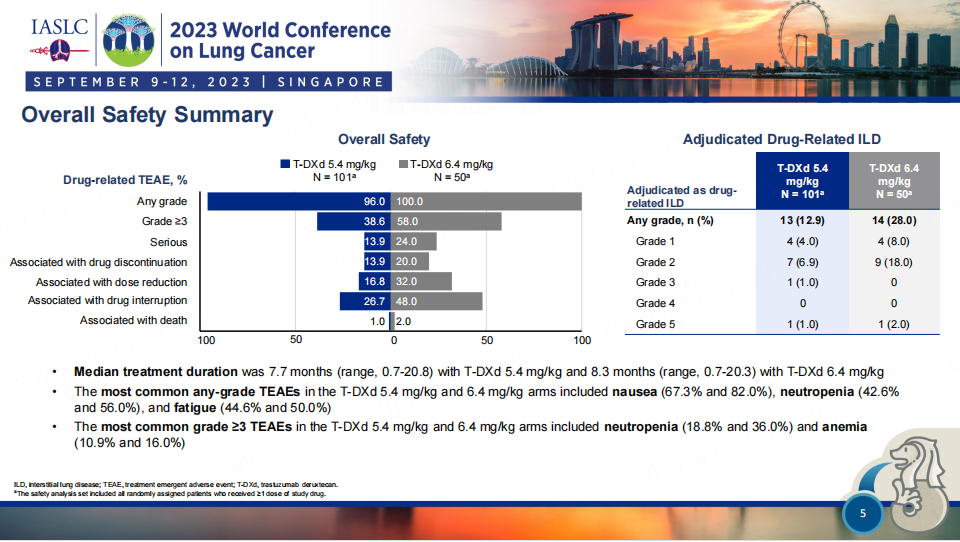
图5. DESTINY-Lung02研究的安全性数据
【结论】
5.4 mg/kg和6.4 mg/kg德曲妥珠单抗在HER2突变NSCLC经治患者中均持续显示出强劲且持久的疗效,以及可管理的安全性。
德曲妥珠单抗 5.4 mg/kg 和 6.4 mg/kg 剂量疗效均能满足临床需求,且安全性可控,其中较低剂量的 5.4 mg/kg 安全性更优。
【评论】
DESTINY-Lung01研究确定了T-DXd在HER2突变NSCLC中的活性,DESTINY-Lung02研究进一步探索了T-DXd在既往接受过治疗的转移性HER2突变NSCLC患者中的最佳剂量。结果显示,低剂量组(5.4mg/kg)的中位无进展生存期(mPFS)达9.9个月,中位总生存期(mOS)达19.5个月,与高剂量组(6.4mg/kg)疗效相当,且低剂量组的安全性更优。同时,T-DXd显示出了良好的颅内抗肿瘤活性,对于基线脑转移患者,低剂量组的颅内客观缓解率(ORR)达50%,颅内缓解持续时间(DoR)达9.5个月。国际多中心、双盲、双臂、随机II期DESTINY-Lung02研究进一步探索了5.4mg/kg与6.4mg/kg德曲妥珠单抗对于HER2突变NSCLC患者的疗效和安全性[1]。
基于临床试验DESTINY-Lung02的阳性结果,美国FDA于2022年宣布T-DXd扩展适应证,用于治疗此前接受过一种系统性治疗的、携带HER2突变的无法切除或转移性NSCLC患者。T-DXd也因此成为用于HER2突变NSCLC的首款药物。
【存在问题】
--
【相似研究】
--
【参考文献】
Goto K, Goto Y, Kubo T, Ninomiya K, Kim SW, Planchard D, Ahn MJ, Smit EF, de Langen AJ, Pérol M, Pons-Tostivint E, Novello S, Hayashi H, Shimizu J, Kim DW, Kuo CH, Yang JC, Pereira K, Cheng FC, Taguchi A, Cheng Y, Feng W, Tsuchihashi Z, Jänne PA. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non-Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol. 2023 Nov 1;41(31):4852-4863. doi: 10.1200/JCO.23.01361. Epub 2023 Sep 11. Erratum in: J Clin Oncol. 2023 Dec 19;:JCO2302574. PMID: 37694347; PMCID: PMC10617843.
|