IPSOS研究是典型的大规模、多中心、随机对照研究,入组患者是分期在IIIB或IV期(按AJCC第7版分期)的驱动基因阴性NSCLC患者,作为阿替利珠单抗对照的是长春瑞滨或吉西他滨单药化疗,研究主要终点设置为OS。
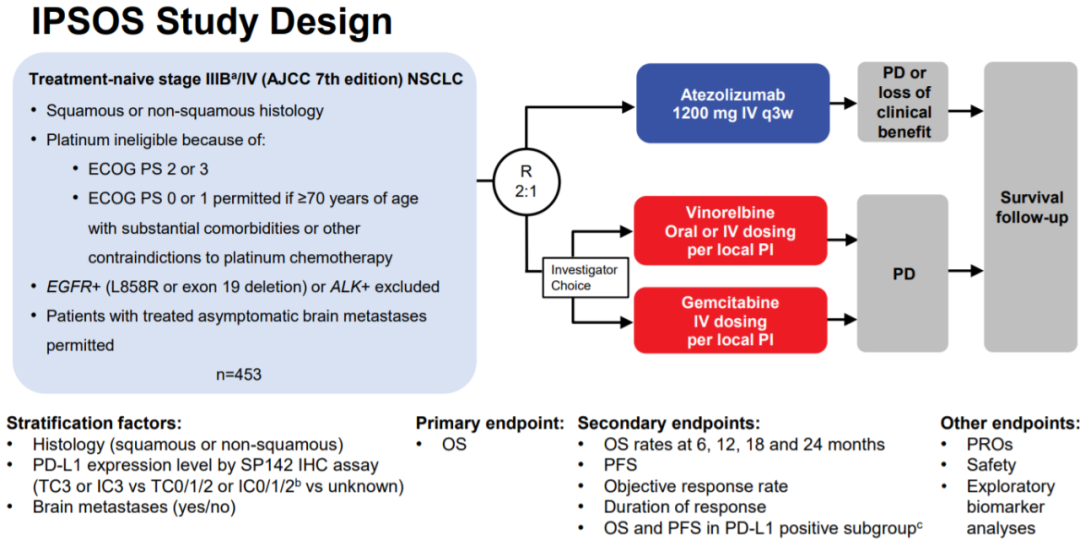
IPSOS研究设计图
从患者基线特征来看,入组患者也确实符合“特殊人群”的特点:患者平均年龄为75岁,且其中有31%是≥80岁的患者;83%患者的PS评分≥2;患者平均合并共病数量则有5-6种,种类也是五花八门。
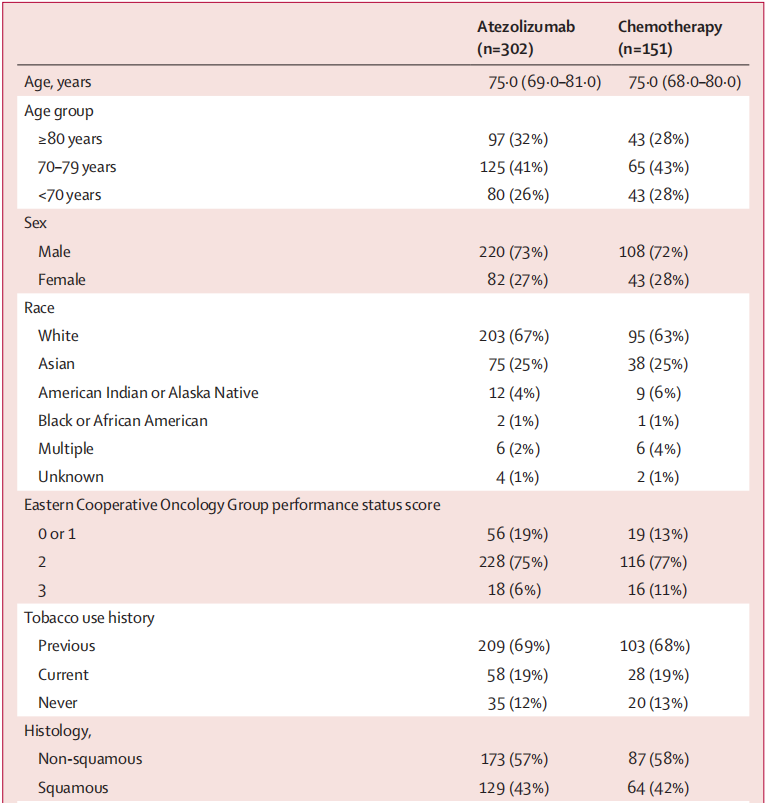
患者基线特征情况
中位随访时间41个月后,阿替利珠单抗组与单药化疗组的中位OS分别为10.3个月和9.2个月,阿替利珠单抗治疗使患者死亡风险显著下降22%(HR=0.78),两组12个月OS率分别为43.7%和38.6%,24个月OS率分别为24.3%和12.4%。
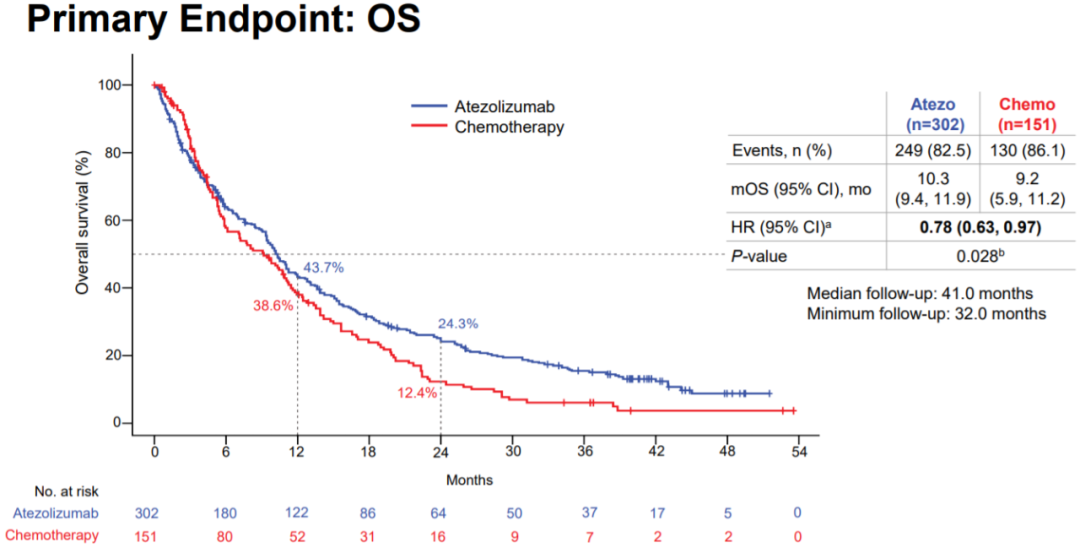
IPSOS研究OS曲线图
亚组分析也显示各关键亚组的OS获益一致,无论患者的PD-L1表达水平、PS评分和组织学类型如何,阿替利珠单抗均可显著改善OS,而且这是建立在允许化疗组患者后续使用免疫治疗的基础上,更显得免疫一线治疗作用明显。
在次要疗效终点方面,阿替利珠单抗组的ORR为16.9%,高于化疗组的7.9%,两组中位缓解持续时间(DoR)分别为14.0个月和7.8个月,这也符合免疫治疗“达到缓解、作用持久”的特点,不过两组的中位无进展生存期(PFS)并无显著差异(4.2个月 vs. 4.0个月, HR=0.87, 95% CI: 0.70-1.07)。
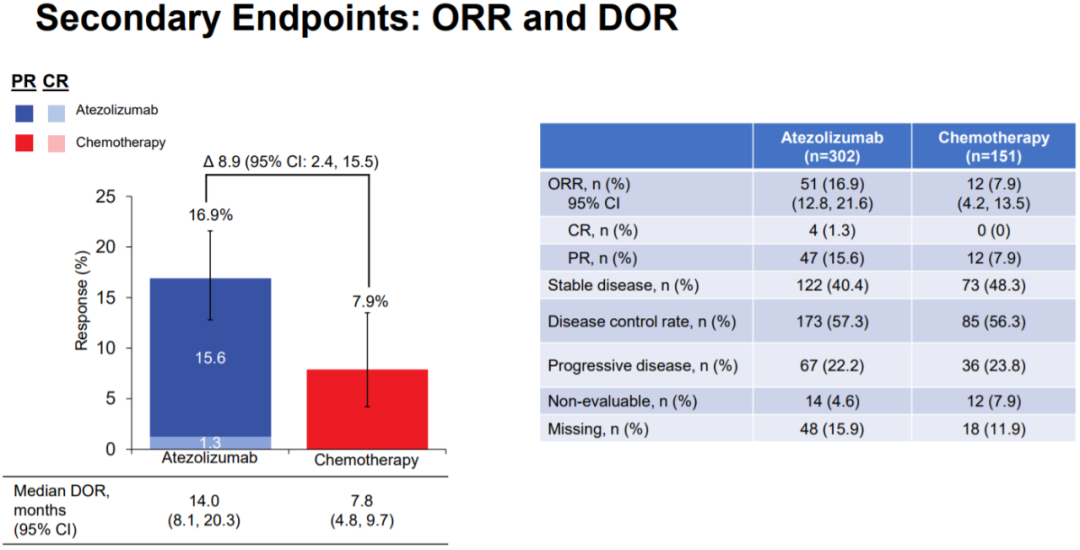
ORR和DOR情况
对患者生活质量的评估显示,阿替利珠单抗治疗能够使患者的食欲减退、便秘、咳嗽、胸痛、呼吸困难等症状实现有临床意义的改善,而化疗组都明显恶化;而且,阿替利珠单抗组3/4级治疗相关不良事件(TRAEs)发生率还相对较低(16.3%/33.3%),这对治疗共病较多、身体状况较差的患者是非常有意义的。
结论:
IPSOS全球首个III期研究,入组不适合含铂化疗人群(高龄、PS 2/3)证实阿替利珠单抗单药较化疗显著改善OS,70-79岁的患者获益更多。
IPSOS达到主要研究终点,阿替利珠单抗单药较化疗显著改善OS,阿替利珠单抗 vs 化疗组患者的mOS分别为10.3 vs 9.2个月,阿替利珠单抗组2年OS率是单药化疗组的2倍(24.3% vs 12.4%); 70-79岁的患者OS获益更多
IPSOS是一项全球性、开放标签、随机对照的III期研究,旨在探索PD-L1抑制剂阿替利珠单抗单药在不适宜一线含铂双药化疗(ECOG PS 2/3、年龄≥70岁且存在合并症)的晚期NSCLC患者中的疗效和安全性。纳入453例患者,随机化接受阿替利珠单抗或化疗,主要终点是0S。
正如研究者们在论文中所述,IPSOS研究是多年来首个证实免疫治疗用于不适合含铂双药化疗患者,可改善生存和生活质量的随机对照临床研究,这也能让临床医生们在用药时更加心中有数,不再因为患者的特殊状况裹足不前。当然了,具体情况具体分析,谨慎评估患者状况、合理应对不良反应,什么时候都不会错。
该研究入组453例分期ⅢB/IV期驱动基因阴性初治NSCLC患者,按2:1的比例随机分配至阿替利珠单抗(1200 mg IV q3w)单药治疗组,或长春瑞滨/吉西他滨单药化疗组。 中位随访时间41个月后,阿替利珠单抗组与单药化疗组的中位OS为10.3个月 vs 9.2个月。与单药化疗相比,阿替利珠单抗治疗使患者死亡风险显著下降22%(HR=0.78,95% CI:0.63~0.97,P=0.028);两组12个月OS率43.7% vs 38.6%,24个月OS率24.3% vs 12.4%。 安全性数据显示,阿替利珠单抗组TRAEs发生率57.0%,化疗组80.3%,两组3~4级TRAEs发生率16.3% vs 33.3%,严重TRAEs发生率11.7% vs 15.6%;两组各有3例和4例患者出现5级TRAE,因不良事件停药的比例为13.0% vs 13.6%。 阿替利珠单抗作为一线治疗晚期NSCLC在改善患者总生存方面优于单药化疗,为无法接受铂类化疗的晚期NSCLC患者提供了新的治疗选择。 IPSOS亚裔亚组分析提示,亚裔人群OS获益优于ITT人群。基于此,2024年CSCO指南首次推荐阿替利珠单抗用于PS 2分人群一线治疗。
来源:
Lee SM, Schulz C, Prabhash K, et al. First-line atezolizumab monotherapy versus single-agent chemotherapy in patients with non-small-cell lung cancer ineligible for treatment with a platinum-containing regimen (IPSOS): a phase 3, global, multicentre, open-label, randomised controlled study [published correction appears in Lancet. 2023 Aug 5;402(10400):450]. Lancet. 2023;402(10400):451-463. doi:10.1016/S0140-6736(23)00774-2
参考文献:
[1]Lilenbaum R C, Cashy J, Hensing T A, et al. Prevalence of poor performance status in lung cancer patients: implications for research[J]. Journal of Thoracic Oncology, 2008, 3(2): 125-129.
[2]Lee S M, Schulz C, Prabhash K, et al. First-line atezolizumab monotherapy versus single-agent chemotherapy in patients with non-small-cell lung cancer ineligible for treatment with a platinum-containing regimen (IPSOS): a phase 3, global, multicentre, open-label, randomised controlled study[J]. The Lancet, 2023.
|