|
1、RET基因的结构与功能
RET(Rearranged during Transfection)原癌基因最早于1985年由 Takahashi等通过人类T细胞淋巴瘤DNA转染小鼠NIH-3T3细胞而发现并命名[1]。RET原癌基因定位于第10号染色体长臂(10q11.21),其DNA全长约为60Kb,含有21个外显子,其编码的RET蛋白属于受体酪氨酸激酶(Receptor tyrosine kinase,RTK)蛋白家族,是由1143个跨膜氨基酸残基构成的蛋白聚合体,具有RTK的经典结构:一个富含半胱氨酸的钙粘连素样细胞外区、一个跨膜区和一个具有催化酪氨酸激酶作用的细胞内区[2]。
RET蛋白的主要配体属于神经胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)家族。RET的生理活化依赖于GDNF家族配体和其共受体GDNF受体-α蛋白家族成员复合物形成,诱导RET同源二聚化及磷酸化,从而激活多个信号转导级联反应,诱导细胞增生,参与调节细胞的生长和分化[3,4]。胚胎发育过程中RET基因对神经系统、肾、内分泌器官、精子等的生长、发育发挥着关键的作用,对成体的影响则主要表现在神经系统[5]。
2、RET基因突变和融合变异可导致肿瘤发生
RET基因的改变在不同类型癌症患者中总的发生率为1.8%,基因改变的类型包括基因突变(38.6%)、基因融合(30.7%)、基因扩增(25%)、基因重排、重复和缺失,其中RET基因点突变和RET基因融合可以使RET基因逃脱配体调控,自我磷酸化强化、信号转导功能增强,促使激酶的活化以及原癌基因的转化,诱发肿瘤生成[6]。
RET基因在肿瘤患者中的活化机制主要包括以下两点[7]:
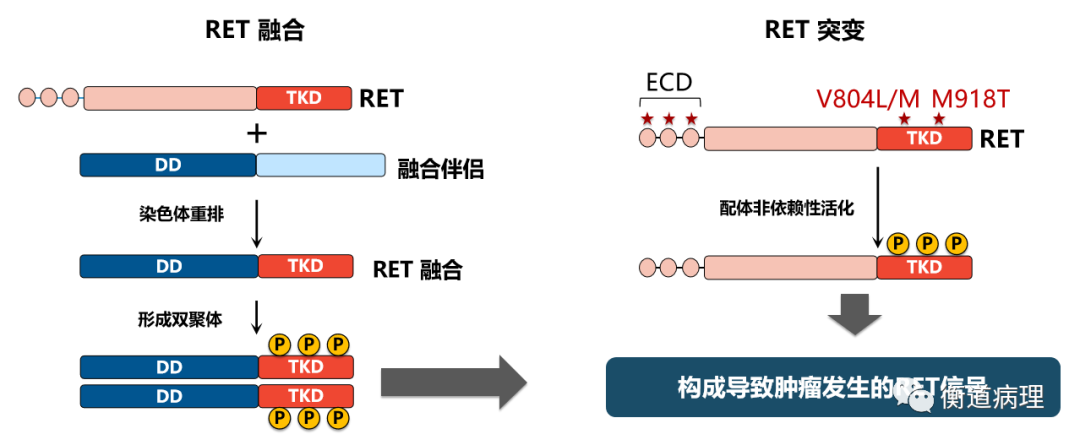
图1 RET融合和突变均可使激酶活化 (DD,二聚化结构域;ECD,胞外域; TKD,酪氨酸激酶域。)
(1) RET基因点突变。RET基因突变包括胚系突变和体细胞突变。RET胚系突变与多发性内分泌腺瘤2型(MEN2)密切相关,包括MEN2A,MEN2B和家族性MTC(FMTC)。MEN2A患者受RET基因C634Y、 C634R位点突变影响,MEN2B患者受RET 基因 M918T位点突变的影响。RET体细胞突变约占散发性MTC的65%,约占所有MTC的四分之三,最常见的突变位点是M918T。RET体细胞突变还与散发性嗜铬细胞瘤、乳腺癌、子宫内膜癌、Merkel细胞癌等多种肿瘤相关。
(2) RET基因融合(图2)。RET融合均为体细胞融合,至今未发现胚系RET融合。不同的染色体间易位或染色体内倒位、串联重复或中间缺失可导致基因融合。RET原癌基因能与多种基因发生融合,常以本身断裂再与另一基因接合的方式,导致RET的激酶结构域编码区的3’端与多种异源上游伴侣基因的5’端发生融合,重组成一个新的基因(融合基因)。常见的伴侣基因包括CCDC6、NCOA4和KIF5B,都定位在10号染色体,通过臂内倒位(CCDC6、NCOA4)和臂间倒位(KIF5B)发生重排。断点主要发生在RET ll号内含子,产生的融合只包括RET的胞内激酶部分;亦可发生在7和10号内含子,产生的融合除了胞内部分,还包括跨膜区。
RET融合导致不依赖配体的二聚化和RET激酶的组成性激活,激活下游信号通路,包括MAPK、PI3K、JAK–STAT、PKA和PKC信号通路,造成细胞的过度增殖。另外,RET融合导致激酶活化还可诱导产生其他细胞因子出现特异生物学表型,最终导致肿瘤的发生和发展[3,4,7]。
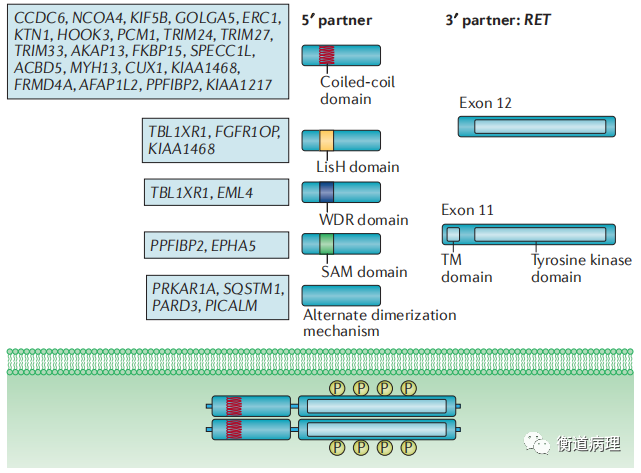
图2 恶性肿瘤中的RET重排[7]
3、RET融合基因的发现以及与RET融合基因相关的肿瘤类型
1990年,Grieco等在甲状腺乳头状癌中检测到RET融合基因CCDC6-RET,这是首次在人类肿瘤组织中发现RET融合基因[8]。RET重排在散发甲状腺乳头状癌中发生率约5-10%,在有辐射暴露史的甲状腺乳头状癌中发生率高达60-80%,CCDC6–RET和NCOA4–RET是PTC中最常见的RET融合基因。2012年,来自韩国、日本及美国的4个独立研究小组分别报道了肺癌中的首个RET融合蛋白KIF5B-RET并明确了其致癌性[9-12]。RET重排在非小细胞肺癌中发生率约1-2%。
除甲状腺乳头状癌和肺癌外,RET基因重排还与多种其他肿瘤的发生和发展有着密切的关系,如结直肠癌、胃癌、胰腺癌、乳腺癌、涎腺导管内癌、慢性粒细胞白血病、Spitz肿瘤等,这些肿瘤中RET基因重排发生率均较低[3,13-14]。
4、非小细胞肺癌中RET融合基因的类型及发生率[9-12,15-32]
迄今为止,非小细胞肺癌中共报道了至少30种RET融合基因类型,见表1。最常见的融合为KIF5B-RET、CCDC6-RET及NCOA4-RET,其发生率见图3。
表1 NSCLC中RET融合基因的类型

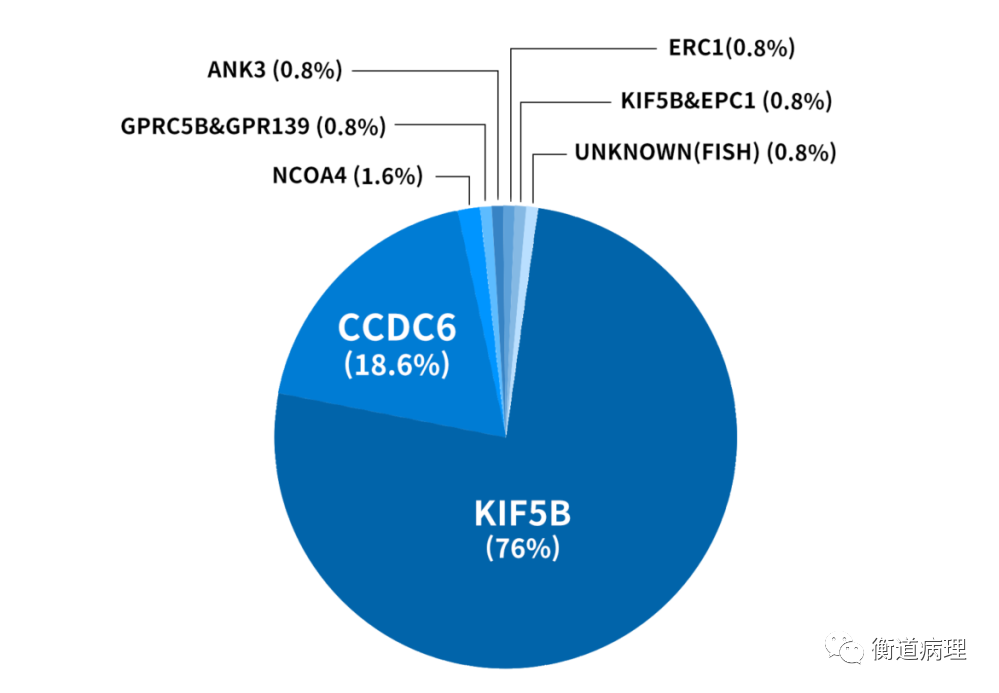
图3 NSCLC中RET基因融合类型分布
5、RET基因融合非小细胞肺癌的临床病理特征
RET融合NSCLC更多表现为:患者相对年轻,多为非吸烟者,组织学类型主要为腺癌,伴有其它驱动基因突变的可能性低,分期晚,易发生脑转移。但在不同的研究中其临床病理特征存在一定差异。
Wang Rui等[33]的研究显示,936例NSCLC中13例(1.4%)检出RET融合基因,其中腺癌11例(11/633,1.7%),腺鳞癌2例(2/24,8.3%),融合类型包括9例KIF5B-RET,3例CCDC6-RET及1例NCOA4-RET。RET基因融合的腺癌患者年龄更年轻(≤ 60 years; 72.7%),多数从不吸烟(81.8%),肿瘤分化更差,组织学亚型多为实体型(63.6%) ,肿瘤体积小(≤ 3 cm) ,多伴有 N2 淋巴结转移 (54.4%),中位无复发生存时间为20.9个月。
一项对欧洲、亚洲和美洲29个中心、165例RET重排非小细胞肺癌患者的研究显示[23],RET重排NSCLC中位年龄为61岁,大多数患者从不吸烟(63%),组织学类型主要为腺癌(98%),临床分期91%为进展期(III/IV期),中位无进展生存期为2.3个月,中位总生存期为6.8个月。
一项中国人群的回顾性研究显示[31],6125例肺癌患者中84例(1.4%)发现RET重排,患者中位年龄58岁,女性稍多(56.0%),组织学类型主要为腺癌(73.8%) ,也有少数鳞状细胞癌及腺鳞癌,KIF5B-RET是最常见的融合类型(53.8%),其中K15-R12是最常见的变异(71.9%)。
Tsuta 等[34]检测了1874例NSCLC,其中22例(1.2%)显示RET融合,组织学类型均为腺癌,乳头型及贴壁型居多,54.5%(12/22)至少局部存在具有胞浆粘蛋白生成的细胞。RET融合NSCLC患者的预后较差,绝大多数(82.7%~91%)确诊时已处于晚期(III/IV期)[22,32,35]。
RET融合NSCLC患者易发生脑转移。一项来自韩国的单中心回顾性研究[35],对59例接受过治疗的RET融合NSCLC患者进行了分析,诊断时已有28.8%(n=17)的患者发生脑转移,随访期间又有18.6%(n=11)的患者发生脑转移,发生脑转移的中位时间为19个月,24个月时脑转移的累积发生率大于60%。
6、RET融合类型及共突变基因对预后的影响
不同RET融合基因亚型NSCLC预后可能存在差异,Aaron 等的回顾性分析显示[36],CCDC6-RET融合患者比KIF5B-RET融合患者总生存期更长(中位总生存期分别为113.5个月及37.7个月)。Chang Lu等[32]的研究中,KIF5B-RET融合患者与非KIF5B的RET融合患者,中位总生存期分别为18.4个月和20.3个月。
RET融合NSCLC约41%~73%存在伴发突变,其中最常见的伴发突变是TP53[31,32],发生率在37.7%~42.5%,并发驱动基因EGFR,KRAS,HER2,BRAF,ALK和ROS1突变少见。Chang Lu等[32]的研究显示伴有TP53突变的患者比不伴TP53突变的患者总生存期短,其中位OS分别为18.4个月与24.8个月。
7、RET融合是NSCLC EGFR-TKI获得性耐药机制之一
绝大多数肺癌接受EGFR-TKI治疗1~2年内会出现耐药,受体酪氨酸激酶(RTK)融合是EGFR-TKI获得性耐药的机制之一。一项回顾性研究[37]分析了3873例EGFR突变肺癌患者的基因组数据,发现其中16例在EGFR-TKI治疗期间发生基因融合,其中6例(37.5%)为RET融合,其余为ALK (n=5, 31.3%), NTRK1 (n=4, 25.0%), ROS1 (n=1, 6.3%), 和 FGFR3 (n=1, 6.3%)融合。
8、RET多激酶抑制剂和选择性抑制剂的耐药机制[38-39]
RET作为酪氨酸激酶受体,与其他酪氨酸激酶在激酶结构域的序列和结构上具有相似性。目前针对RET的靶向药物多为多靶点RTK抑制剂如Cabozantinib, Lenvatinib, Sorafenib, Vandetanib, Ponatinib, Sunitinib和Alectinib。一系列的临床试验也显示了多激酶抑制剂在RET融合NSCLC中的治疗作用。RET选择性抑制剂Selpercatinib (LOXO-292) 和Pralsetinib (BLU-667) 最近在晚期RET融合阳性NSCLC中表现出了良好的抗肿瘤活性和安全性,两者都获得了美国FDA对这一适应症的批准。
RET多激酶抑制剂和选择性抑制剂耐药机制主要包括以下三种:RET二次突变(如RET Gatekeeper突变V804L/M),获得RET以外的其它突变以及旁路激活。
表2 RET多激酶抑制剂和选择性抑制剂的耐药机制[38]
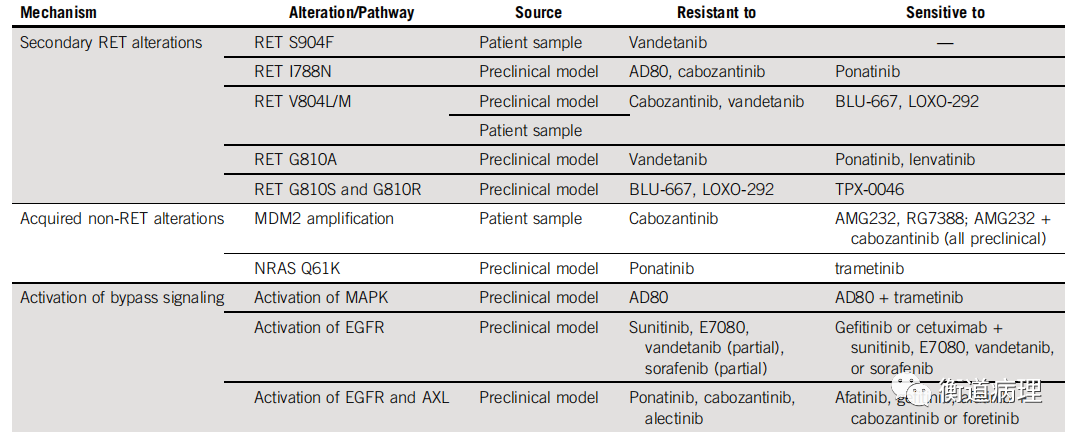
Lin等分析了选择性RET抑制剂的耐药机制。通过分析18例RET融合NSCLC接受Selpercatinib或Palsetinib治疗后23份活检或血浆样本,利用NGS及FISH分析耐药分子机制,发现2例(10%)耐药患者中检测到RET G810突变,分别为G810S和G810C;3例(15%)耐药患者中检测到MET扩增;1例患者中发现KRAS扩增。高选择性RET抑制剂耐药机制包括RET二次突变和旁路激活(如MET扩增),后者更为常见。
参考资料:(向上滑动阅览)
1. Takahashi M, Ritz J, Cooper GM. Activation of a novel human transforming gene, ret, by DNA rearrangement. Cell. 1985 Sep;42(2):581-588. 2. Ishizaka Y, Itoh F, Tahira T, et al. Human ret proto-oncogene mapped to chromosome 10q11.2. Oncogene. 1989 Dec;4(12):1519-1521. 3. Kohno T, Tabata J, Nakaoku T. REToma: a cancer subtype with a shared driver oncogene. Carcinogenesis. 2020 Apr 22;41(2):123-129. 4. Gainor JF and Shaw AT. Novel targets in nonsmall cell lung cancer: ROS1 and RET fusions. Oncologist 2013; 18: 865–875. 5. Schenck Eidam H, Russell J, Raha K, et al. Discovery of a First-in-Class Gut-Restricted RET Kinase Inhibitor as a Clinical Candidate for the Treatment of IBS. ACS Med Chem Lett. 2018 May 24;9(7):623-628. 6. Kato S, Subbiah V, Marchlik E, et al. RET Aberrations in Diverse Cancers: Next-Generation Sequencing of 4,871 Patients. Clin Cancer Res. 2017 Apr 15;23(8): 1988-1997. 7. Drilon A, Hu ZI, Lai GGY, et al. Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes. Nat Rev Clin Oncol. 2018 Mar;15(3):151-167. 8. Grieco M, Santoro M, Berlingieri MT, et al. PTC is a novel rearranged form of the ret proto-oncogene and is frequently detected in vivo in human thyroid papillary carcinomas. Cell. 1990 Feb 23;60(4):557-563. 9. Ju YS, Lee WC, Shin JY, et al. A transforming KIF5B and RET gene fusion in lung adenocarcinoma revealed from whole-genome and transcriptome sequencing. Genome Res. 2012 Mar;22(3):436-445. 10. Kohno T, Ichikawa H, Totoki Y, et al. KIF5B-RET fusions in lung adenocarcinoma. Nat Med. 2012 Feb 12;18(3):375-377. 11. Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer. Nat Med. 2012 Feb 12;18(3):378-81. 12. Lipson D, Capelletti M, Yelensky R, et al. Identification of new ALK and RET gene fusions from colorectal and lung cancer biopsies. Nat Med. 2012 Feb 12;18(3):382-384. 13. Santoro M, Moccia M, Federico G, et al. RET Gene Fusions in Malignancies of the Thyroid and Other Tissues. Genes (Basel). 2020 Apr 15;11(4):424. 14. Takeuchi K. Discovery Stories of RET Fusions in Lung Cancer: A Mini-Review. Front Physiol. 2019 Mar 19;10:216. 15. Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer. Nat Med. 2012 Feb 12;18(3):378-381. 16. Wang R, Hu H, Pan Y, et al. RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer. J Clin Oncol. 2012 Dec 10;30(35):4352-4359. 17. Drilon A, Wang L, Hasanovic A, et al. Response to Cabozantinib in patients with RET fusion-positive lung adenocarcinomas. Cancer Discov. 2013 Jun;3(6):630-5. 18. Zheng Z, Liebers M, Zhelyazkova B, et al. Anchored multiplex PCR for targeted next-generation sequencing. Nat Med. 2014 Dec;20(12):1479-84. 19. Lira ME, Choi YL, Lim SM, et al. A single-tube multiplexed assay for detecting ALK, ROS1, and RET fusions in lung cancer. J Mol Diagn. 2014 Mar;16(2):229-243. 20. Nakaoku T, Tsuta K, Ichikawa H, et al. Druggable oncogene fusions in invasive mucinous lung adenocarcinoma. Clin Cancer Res. 2014 Jun 15;20(12):3087-93. 21. Drilon A, Rekhtman N, Arcila M, et al. Cabozantinib in patients with advanced RET-rearranged non-small-cell lung cancer: an open-label, single-centre, phase 2, single-arm trial. Lancet Oncol. 2016 Dec;17(12):1653-1660. 22. Lee SH, Lee JK, Ahn MJ, et al. Vandetanib in pretreated patients with advanced non-small cell lung cancer-harboring RET rearrangement: a phase II clinical trial. Ann Oncol. 2017 Feb 1;28(2):292-297. 23. Gautschi O, Milia J, Filleron T, et al. Targeting RET in Patients With RET-Rearranged Lung Cancers: Results From the Global, Multicenter RET Registry. J Clin Oncol. 2017 May 1;35(13):1403-1410. 24. Velcheti V, Thawani R, Khunger M, et al. FRMD4A/RET: A Novel RET Oncogenic Fusion Variant in Non-Small Cell Lung Carcinoma. J Thorac Oncol. 2017 Feb;12(2):e15-e16. 25. Zhang X, Li Y, Liu C, et al. Identification of a novel KIF13A-RET fusion in lung adenocarcinoma by next-generation sequencing. Lung Cancer. 2018 Apr;118:27-29. 26. Velcheti V, Madison R, Ali SM, et al. WAC/RET: A Novel RET Oncogenic Fusion Variant in Non-Small Cell Lung Carcinoma. J Thorac Oncol. 2018 Jul;13(7):e122-e123. 27. Peng P, Zheng Y, Lv J. TBC1D32-RET: A Novel RET Oncogenic Fusion in Lung Adenocarcinoma. J Thorac Oncol. 2019 Jan;14(1):e7-e9. 28. Jiang H, Xiao M, Qi C, et al. A Novel Oncogenic RET Fusion Variant in Non-Small Cell Lung Cancer: RELCH-RET. J Thorac Oncol. 2020 Feb;15(2):e27-e28. 29. Lv Y, Ling F, Zhang J, et al. A Novel Intergenic LSM14A-RET Fusion Variant in a Patient With Lung Adenocarcinoma. J Thorac Oncol. 2020 Apr;15(4):e52-e53. 30. Peng P, Zheng Y, Lv J. TBC1D32-RET: A Novel RET Oncogenic Fusion in Lung Adenocarcinoma. J Thorac Oncol. 2019 Jan;14(1):e7-e9. 31. Zhang K, Chen H, Wang Y, et al. Clinical Characteristics and Molecular Patterns of RET-Rearranged Lung Cancer in Chinese Patients. Oncol Res. 2019 May 7;27(5):575-582. 32. Lu C, Dong XR, Zhao J, et al. Association of genetic and immuno-characteristics with clinical outcomes in patients with RET-rearranged non-small cell lung cancer: a retrospective multicenter study. J Hematol Oncol. 2020 Apr 15;13(1):37. 33. Wang R, Hu H, Pan Y, et al. RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer. J Clin Oncol. 2012 Dec 10;30(35):4352-9. 34. Tsuta K, Kohno T, Yoshida A, et al. RET-rearranged non-small-cell lung carcinoma: a clinicopathological and molecular analysis. Br J Cancer. 2014 Mar 18;110(6):1571-1578. 35. Lee J, Ku BM, Shim JH, et al. Characteristics and outcomes of RET-rearranged Korean non-small cell lung cancer patients in real-world practice. Jpn J Clin Oncol. 2020 May 5;50(5):594-601. 36. Tan AC, Seet AOL, Lai GGY, et al. Molecular Characterization and Clinical Outcomes in RET-Rearranged NSCLC. J Thorac Oncol. 2020 Aug 28:S1556-0864(20)30671-7. 37. Xu H, Shen J, Xiang J, et al. Characterization of acquired receptor tyrosine-kinase fusions as mechanisms of resistance to EGFR tyrosine-kinase inhibitors. Cancer Manag Res. 2019 Jul 9;11:6343-6351. 38. Subbiah V, Yang D, Velcheti V, et al. State-of-the-Art Strategies for Targeting RET-Dependent Cancers. J Clin Oncol. 2020 Apr 10;38(11):1209-1221. 39. Lin JJ, Liu SV, McCoach CE, et al. Mechanisms of Resistance to Selective RET Tyrosine Kinase Inhibitors in RET Fusion-Positive Non-Small Cell Lung Cancer. Ann Oncol. 2020 Sep 29:S0923-7534(20)42465-2.
|