肺转移瘤切除术专家共识

肺转移瘤切除术专家共识
John R. Handy, MD, Ross M. Bremner, MD, Todd S. Crocenzi, MD,Frank C. Detterbeck, MD, Hiran C. Fernando, MD, Panos M. Fidias, MD,Scott Firestone, MS, Candice A. Johnstone, MD, Michael Lanuti, MD,Virginia R. Litle, MD, Kenneth A. Kesler, MD, John D. Mitchell, MD, Harvey I. Pass, MD,Helen J. Ross, MD, and Thomas K. Varghese, MD
美国俄勒冈州波特兰Providence卫生与服务机构胸外科;亚利桑那州菲尼克斯圣约瑟夫医院暨医疗中心Norton胸科研究所;俄勒冈州波特兰Providence癌症中心医学肿瘤科;康涅狄格州纽黑文耶鲁大学医学院胸外科;弗吉尼亚州福尔斯彻奇Inova Fairfax医学中心心胸外科;新罕布什尔州埃克塞特癌症护理中心医学肿瘤科;伊利诺伊州芝加哥美国胸外科医师学会;威斯康星州密尔沃基威斯康星医学院放射肿瘤科;马萨诸塞州波士顿马萨诸塞总医院外科胸外科;马萨诸塞州波士顿波士顿大学医学中心外科;印第安纳州印第安纳波利斯印第安纳大学医学院胸外科;科罗拉多州奥罗拉科罗拉多大学医学院外科;纽约州纽约市朗格尼医学中心纽约大学医学院心胸外科;亚利桑那州菲尼克斯梅奥诊所血液/肿瘤科;犹他州盐湖城犹他大学心胸外科。
专家共识要点 1.在为患有癌症并出现肺寡转移(oligometastases)的患者提供治疗时,应在多学科团队(MDT)框架内考虑实施肺转移瘤切除术(PM),并根据患者具体情况慎重个体化处理。 2.对于肿瘤学条件和身体状况均合适的非小细胞肺癌(NSCLC)患者,从PM手术切除的组织应送检进行基因/分子分析(包括程序性死亡配体1,PD-L1),以指导未来的治疗。 3.对于肿瘤学条件和身体状况均合适的患者,可以考虑实施PM,优先选择微创手术(MIS),因为微创手术可缩短术后恢复时间并减少对生活质量的短期影响。 4.如果无法通过微创手术实现R0切除并保留尽可能多的肺实质,但通过开胸手术(如开胸切口、胸骨切开或“蛤壳”切口)可以达到上述目标,则应采用开胸手术方式。 5.不建议为实施PM而进行全肺切除术(肺叶全切除除外),除非是在经过多学科团队慎重评估后严格筛选的患者中进行。 6.尽管肺转移病灶的绝对数量本身并非PM的直接禁忌症,但最佳的PM候选人应为肺内仅有3个或更少转移灶的患者。 7.在进行PM的同时应考虑淋巴结(LN)的取样或清扫,因为肺转移瘤伴有纵隔LN转移往往预示着较差的生存预后。 8.对于肺寡转移患者,热消融或立体定向消融性体部放射治疗(SABR)是合理的局部治疗选择,特别适用于被认为手术风险高或拒绝手术的患者。 9.除临床研究外,不主张将隔离肺灌注(ILP)用于肺转移瘤的治疗。 10.对于结直肠癌患者,可在MDT框架下考虑PM手术,并在PM手术前后结合全身治疗。 11.对于肾细胞癌患者,可在MDT框架下考虑PM手术。 12.对于恶性黑色素瘤患者,可在MDT框架下考虑PM手术。 13.对于肉瘤患者,可在MDT框架下考虑PM手术。 14.在头颈部肿瘤的治疗中,当疾病无瘤间隔期(DFI)超过12个月、肺转移灶可完全切除且无淋巴结转移时,可以考虑实施PM。 15.在治疗非精原性生殖细胞肿瘤(NSGCT)时,对于经铂类化疗后残留的≥10 mm肺部病灶且患者血清肿瘤标志物已恢复正常、怀疑其中含有畸胎瘤成分的情况,应进行PM手术。 16.在治疗NSGCT时,如果一侧肺PM手术的病理结果显示肿瘤完全坏死,则对对侧肺内的异常病灶可以采取观察策略。 17.在治疗NSGCT时,对于经一线或二线铂类化疗后仍残存少量肺部异常且怀疑其中有存活的非精原性癌成分或畸胎瘤恶性转化的特定患者,可考虑实施PM。 18.对于乳腺癌患者,可在MDT框架下考虑PM手术。
引言
肺转移瘤切除术(PM)长期以来一直在临床中实践,尽管支持其应用的文献证据水平并不高。鉴于需要一定程度的规范化,美国胸外科医师学会(STS)循证外科工作组成立了一个特别任务小组,并按照STS专家共识制定流程对“肺转移瘤切除术”进行了讨论。该任务小组成员包括胸外科医师、内科肿瘤医师和放射肿瘤医师。本文即为最终形成的专家共识文件。由于支持文献存在诸多缺陷,本共识并未上升到正式指南的级别。
PM文献特征
自1980年以来,有超过1000篇文献讨论了PM,但其中没有一项是随机对照试验。多数研究为手术病例系列报道,通常来自单一机构,且包含单一或多种原发肿瘤病理类型。这些研究并未报告接受PM患者所来源的肿瘤患者总体基数,因此无法进行生存率的对照分析。通常使用历史对照,或者假设转移性疾病不做手术干预时生存率为零,但文献并不支持这一假设。然而,当报告大规模肿瘤患者人群时,实施肺转移瘤切除术的比例并不高(仅占1%~6.5%)。因此,这些手术病例系列研究存在内在的选择偏倚,无法明确PM在延长生存或治愈中的作用。文献还存在其他局限,包括对同时采用的其他局部或全身治疗描述不一致或缺失,以及随访时间长短不一。
最后,现有文献未能区分预后因素和预测因素。所谓预后因素,是指病情惰性的患者无论接受任何治疗(甚至不治疗)预后都会较好;而预测因素则旨在区分某种特定治疗对患者是否“可能”有益。作为PM候选者的一些预测不良因素包括:原发恶性肿瘤未受控、存在肺外转移灶、无法达到R0切除,以及纵隔淋巴结阳性等。这些因素通常被视为手术禁忌,从而在手术系列中进一步加重了选择偏倚。
仅有少数登记研究(总计8篇)在很大程度上界定了PM的临床实践。其中影响最大的一项报告了国际肺转移登记研究(IRLM)中5206例具有多种病理类型的患者。然而,该研究同样没有给出接受PM患者所来源的总体肿瘤患者人数(缺少分母数据),其结果见表1。

表1. 肺转移瘤切除术相关文献的一般特征:无随机对照试验,广泛存在选择偏倚,无生存率比较分析,对伴随采用的局部或全身治疗描述不一致,随访时间长短不一。
方法学
肺转移瘤切除术专家共识任务小组受STS循证外科工作组委托,旨在在现有PM文献局限的背景下为临床医生提供具有临床相关性的指导。我们在MEDLINE中检索了1990年以来英文发表的相关文献,使用的检索主题词包括“肺肿瘤+继发”(lung neoplasms + secondary)、“转移瘤切除术”(metastasectomy)、“肺切除术”(pneumonectomy)、“开胸术”(thoracotomy)和“视频辅助胸外科手术”(thoracic surgery, video-assisted),并结合多种原发肿瘤类型进行搜索。作者可自行选择相关文献纳入本文;由于总体上缺乏对照组,我们未能进行系统综述。
共识声明采用改良的德尔菲(Delphi)方法制定。针对拟议的共识陈述,采用5点Likert量表进行投票表决。要求作者中至少有80%参与投票,而当75%以上的参与者选择“同意”或“非常同意”时,则认为该条目达成共识。在第一轮投票中有3条声明未达到75%的同意率,这些声明经细微修改后又进行了第二轮投票,随后被纳入共识。由于此次采用的是STS专家共识流程,其结果是意见性声明而非正式推荐,我们未采用美国心脏病学会基金会/美国心脏协会用于临床实践指南的证据等级分类体系。
治疗的总体概念框架及PM的作用
本共识讨论的重点是在肿瘤非局限状态下应用局部治疗,即切除或消融肺转移灶的作用。明确临床情境和治疗目标非常重要。对于存在孤立肺转移灶且原发肿瘤在肺外的患者,进行PM的前提是原发病灶已得到控制,且体内无其他转移(如有其他转移灶,也应已积极控制)。普遍接受的观点是,如果尚有其他病灶未处理,那么实施PM意义不大。这一广为接受的共识仅基于逻辑推断(缺乏数据支持),但反之意见难以成立(即,很难提出相反观点来支持在存在未处理的多发转移时仍进行PM)。需要说明的是,在某些情况下关于治疗时序存在不同意见:例如,对于结肠癌的肝转移和肺转移,有时PM的时序可能相对于控制原发灶或其他转移(如肝转移)的顺序有所不同;但根本理念是不论顺序如何,只有在已对所有已知病灶进行了明确处理的情况下才考虑进行PM。这份共识未涉及所谓“顽固转移灶”(rogue metastasis)的情形,即当其他转移灶控制良好(但仍存在)且病情稳定时,出现个别对治疗无响应的转移灶。这种情况是一个新兴议题,涉及复杂的问题,超出了本文范畴。
一个简单的物理模式常用于解释转移过程,认为解剖和机械因素(血管和淋巴系统)决定了肿瘤如何转移(血行播散或淋巴播散)。这个模式虽然简单且具有吸引力,但却与许多观察结果相矛盾。不同的原发肿瘤表现出对特定转移部位的偏好。此外,即使在早期癌症患者中,循环肿瘤细胞也常常存在于血流中,然而这些患者中许多人在随后的病程中从未发展出转移灶。
大量文献表明,转移是一个复杂的多步骤过程。在此过程中,癌细胞会发生表型转化(在上皮-间质转换之间反复变化)。肿瘤细胞可同时以多种不同形式存在,由异质性的亚克隆组成,并可在机体许可的微环境中长期潜伏。转移过程的各个阶段受肿瘤细胞内在的基因和表观遗传因素以及复杂的肿瘤-宿主相互作用所影响(例如,有利的微环境、血管生成,以及肿瘤特性使机体免疫反应无法启动等)。面对如此大量的证据,我们必须谨慎对待过于简化的转移机制假说,不应教条地坚持单纯的物理解剖模型,因为它明显过于简化。
历史上,进行PM的目标在于治愈。要实现这一目标,必须根治性处理所有病灶,其成效应以长期无复发生存(无瘤生存率,DFS)来衡量。然而,对于多长的无病生存可视为“长期”,并无明确定义;事实上,对于进展迅速的肿瘤和惰性肿瘤而言,“长期”的含义可能不同。即便没有不接受PM的对照组,一个简单定义长期DFS率的方法在临床上也是有用的。然而,如果考虑到反复手术切除复发灶仍有可能治愈,这将使DFS这一结局指标的应用变得复杂。有人提出可以用总生存期(OS)近似替代DFS和治愈率的概念,但我们必须认识到这并不完美,尤其当考虑惰性肿瘤以及其他非PM治疗(文献中对此类信息很少)时更是如此。
在实践中,从不抽象地孤立考虑PM。讨论PM总是在有可能进行全身治疗的背景下进行,全身治疗可能作为替代方案,或在PM之前或之后作为辅助手段。这给界定PM的作用带来了困难,并导致治疗策略的变化,这些差异可能影响结局。对于一些常见发生肺转移的肿瘤(结直肠癌、肾癌、黑色素瘤、生殖细胞肿瘤及乳腺癌),其初诊时间、原发肿瘤切除与转移出现之间的间隔(DFI)、是否存在其他转移部位,以及既往全身治疗类型等因素都会影响是否选择PM。一般而言,初诊时肿瘤负荷越小、原发治疗完成后无瘤间隔越长、既往系统治疗反应越好、患者整体状态越佳的情形下,实施PM可能获益的概率越大。
PM切除术是否带来治愈?
在遵循传统外科原则的前提下(包括控制原发肿瘤,无肺外转移,R0完全切除,以及患者有足够储备耐受手术),PM在多种病理类型中均显示出提供长期生存(OS和DFS)甚至“治愈”的可能性。较少提及但也相关的因素包括淋巴结受累情况、DFI长短以及转移灶的数量。当满足上述条件时,近期文献报道的OS曲线尾部趋于平坦:例如,结直肠癌在7~9年的OS为20%~52%;肾细胞癌7年OS为33%;黑色素瘤10年OS为14%;软组织肉瘤7~11年OS为11%~23%;头颈部鳞癌13年OS为18%;乳腺癌18年OS为40%;肝细胞癌10年OS为38%。
PM切除术是否延长生存(即使未治愈)?
要评估PM是否延长生存,应比较接受PM的患者与类似但未接受PM患者的OS。这不仅需要生存率数据,还需要可比的对照组,因此获取有关“延长生存”方面的证据很困难。现有报告中,OS通常长于DFS,这意味着PM可能带来了生存获益:例如,结直肠癌患者中,9年OS为52%,DFS为38%;另有报道7.5年OS为20%,DFS为17.5%。软组织肉瘤7年OS为23%,DFS为8%;肝细胞癌10年OS为38%,DFS为30%。以肺癌为例,所谓的“少转移”(oligometastatic)疾病与第二原发癌有时难以可靠地区分,除非从病理上证明病灶属于不同的原发。若患者肺部病灶无淋巴结转移、出现在既往癌前病变区域、无其他转移且原发与继发肿瘤诊断间隔较长,则提示这些病灶可能是新的第二原发癌而非转移癌。切除真正的第二原发癌具有很高的治愈可能性,因此如果无法确定病灶性质,应倾向于手术切除。一些小样本系列研究显示,无论原发肿瘤病理为何,在手术切除同步肺癌病灶的患者中,其5年生存率约为40%,这提示即使在初诊呈少转移状态的患者,切除治疗仍可能有益。
姑息治疗: 目前缺乏将PM用于症状姑息的相关数据。由于肺转移罕有引起症状的情况,将PM作为姑息手段的情况很少见。然而从理论上说,对于有症状且能耐受手术的患者,可以考虑PM;某些情况下,例如转移瘤引起疼痛、梗阻或出血,只要在安全范围内,手术切除或消融这些病灶也许有益。极少数情况下,肺转移可导致气道阻塞(通常可通过支气管镜下姑息手段缓解)。
多学科治疗的整合:何时以及如何将PM与全身治疗结合
多学科团队(MDT)管理应是肺转移患者治疗和筛选的基石。关于肺转移瘤切除与全身治疗的时序及结合非常复杂,需要相关领域专家共同讨论;同时,对于局部疗法(包括手术切除、SABR立体定向放疗、经皮消融)与单纯全身治疗的风险/获益评估,也需要综合考量。经验性文献支持对某些进展缓慢的疾病采用转移瘤切除策略,例如部分肉瘤、肾癌、部分黑色素瘤、肺癌、类癌和结直肠癌等。对于能够耐受手术的患者,具有以下特征的肿瘤倾向于优先选择手术切除:如生殖细胞肿瘤,在化疗后残余病灶主要为畸胎瘤且如果遗留体内可能演变为恶性成分;又如肾细胞癌和黑色素瘤这类对放化疗不敏感的疾病也倾向于优先考虑手术。
近年来,靶向治疗和免疫疗法的出现极大改变了上述肿瘤的治疗格局。但尽管部分患者对免疫治疗反应持久且显著,这毕竟只占少数(显著响应率约20%)。而靶向治疗的响应率较高但持续时间较短,因此PM仍是需要考虑的手段。关于何时实施手术以及新辅助或辅助全身治疗的作用,目前文献资料有限。
在仅有孤立肺转移的临床情境中,内科肿瘤医师的角色是评估患者总体预后、判断全身治疗的作用,并就手术切除的必要性、目的和时机提供意见。需要考虑的重要因素包括原发肿瘤的控制状态、无瘤生存期长短、疾病的自然史、病理类型、分子基因特征,以及有效全身治疗手段的可用性。对于某些疾病(如黑色素瘤或肾癌),先给予一段时间的免疫治疗或靶向治疗可能是适当的,可将手术切除保留为巩固疗法,使患者达到无病状态;或者在出现难治但局限的症状性病灶时,将手术作为补救措施。
目前对于通过局部手段控制转移灶的兴趣日益增长,这是一个正在积极研究的领域。特别是在存在可“靶向”驱动基因突变的情况下,大部分患者即使在影像上疾病进展仍会继续接受全身治疗,因为全局获益已经确立。对于这类患者,治疗重点正转向在持续全身治疗的同时处理个别进展的转移病灶。然而,一般来说,对于已经通过手术达到无瘤状态的患者,“辅助”治疗(尤其是化疗)的价值有限——例如,在结直肠癌或肉瘤患者中,如果通过手术已经使患者无瘤,术后再给化疗并无明确益处。关于PM与全身治疗完成之间的最佳时间间隔、以及术前停用会影响伤口愈合的靶向药物的安全间隔,文献并无明确指导。常见的经验做法是在手术前尽可能实现全身疾病控制。如果相隔数周的连续影像检查显示病灶稳定且无进一步缩小,且患者性能状态良好,则会很快安排PM手术或消融治疗。多数用于肺癌的酪氨酸激酶抑制剂对伤口愈合影响甚微。在存在驱动基因突变的情况下,中断靶向治疗是不利的。因此,例如对表皮生长因子受体(EGFR)酪氨酸激酶抑制剂的处理通常是仅在手术前1~2天停药,术后1~2天即恢复治疗。
患者评估与选择
PM适应证与排除标准
对于具有肺部孤立转移且原发肿瘤在肺外的患者而言,我们默认原发病灶已经得到控制,且体内没有其他系统性转移(若有,也已在积极控制中)。目前并无证据能够为所有肿瘤类型统一界定“少转移”疾病或足够的无瘤间隔期(DFI)标准。
影像学评估
PM患者的影像检查与评估原发肺癌可切除性的流程并无不同。确定肺内转移灶的数量、位置及技术上可切除性,首选胸部CT扫描。为评估肺外病灶,可行全身PET-CT检查(如果原发肿瘤为PET显影阳性肿瘤——许多肾癌在PET上并不显影)。
风险评估
手术“风险”一般定义为住院期死亡率或发病率。对拟行PM患者的风险评估,与评估原发肺癌手术适应证时所用的标准并无不同。通过临床检查可了解呼吸困难程度、体能状态及运动耐力,再辅以肺功能测试(包括肺活量和一氧化碳扩散容量),通常即可评估手术风险。如果仍不确定患者能否耐受手术,则可进行进一步评估(如爬楼试验、6分钟步行试验、心肺运动试验)。用于判定原发肺癌肺叶切除术风险的各项指标,同样适用于评估PM手术适应证(见图1)。
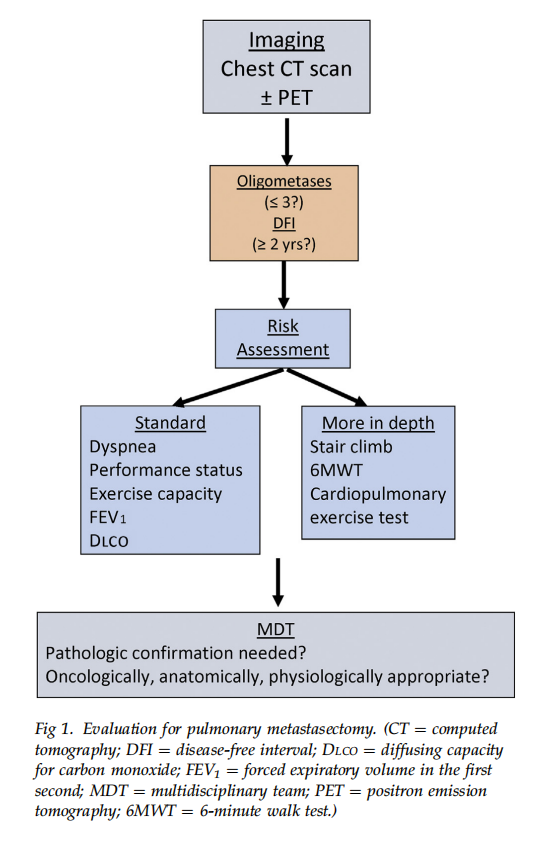
肿瘤复发与重复PM
原则上,既然患者从一开始即被诊断为转移性疾病,那么对于PM术后肺转移复发的情形,应考虑的因素与初次手术时相同。这些因素包括无瘤间隔期持续时间、患者总体预后、预期全身治疗获益,以及患者症状等。随着复发次数增加,DFI往往逐渐缩短,症状愈加明显,全身治疗的价值也降低。在此情况下,治愈已极不可能,实现姑息并延长生存成为治疗的理想目标。
手术目标
当某病灶尚未经过病理学证实为转移时,通过手术获取诊断就是一个无可争议的目标。如果考虑将PM作为治疗手段(无论意在治愈或长期姑息),则手术目标包括:R0切除、尽量保留肺实质、明确疾病范围(行淋巴结清扫),以及在少数情况下缓解症状。若无法实现R0切除这一首要目标,则不应将PM作为治疗手段。
手术安全性:发病率和死亡率
总体而言,PM是安全的。多项研究累计报道了共6122例患者,其中4644例(75%)采用肺叶次全切除术(楔形切除或段切除),这是最常见的切除方式。另外25%的病例中采用了肺叶切除术,极少数采用全肺切除术。围手术期安全性也反映在这一偏向保留肺实质的手术偏好上。在这些报道中,手术死亡率为1.1%(71/6122例),而有报告发病率的数据中并发症发生率约为11%(916例患者中102例发生并发症)。平均住院时间为4.8~7.3天。
肺转移瘤外科切除的技术要点(见图2)
切除范围
为了达到R0切除的必要性决定了需要采取的切除范围。大多数情况下采用小于肺叶切除的方式,从而尽可能保留肺实质组织。仅在少数情况下需要肺叶切除。全肺切除在这种患者群中极少适用,其必要性也存在疑问。
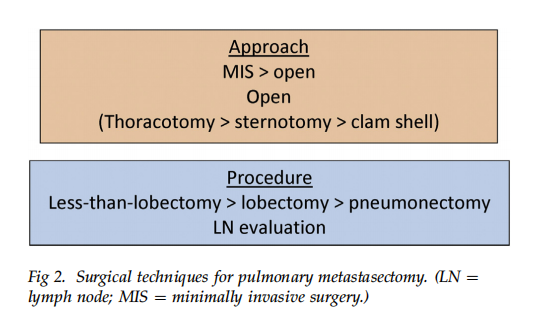
手术入路
传统观点认为,存在多个转移灶时需要手术医生用手触诊才能发现所有病灶。然而,现代CT扫描分辨率极高,CT很可能检测出绝大多数转移灶;即使不能发现全部病灶,也至少能检出那些即便触诊也能摸到的病灶。当病灶较小且多发时,定位确实会有难度。触诊可为查找病灶提供触觉反馈,而胸腔镜手术在这方面存在局限。通过胸腔镜操作孔插入手指或使用环钳等器械对肺进行触诊,可以在胸腔镜下帮助发现病灶。当然,术中密切结合实时CT影像与肺解剖结构也是非常重要的。文献中描述了多种辅助定位技术,包括经皮置入金属圈或导丝、琼脂注射、染料标记等,但鲜有数据证明其具有成本效益。这类技术更多取决于术者个人经验和偏好,在可见的未来可能仍是个体化选择。在至少结直肠癌肺转移患者中,手术入路(胸腔镜 vs. 开胸)对DFS并无显著影响。
当病灶多发或难以定位而需要采用开放手术时,还需要决定最佳的切口入路。对于曾接受博来霉素治疗(如睾丸癌患者)的人群,应避免使用单肺通气和高氧浓度麻醉,因为高浓度氧可导致这类患者发生肺纤维化的风险升高。如果存在双侧肺转移,可考虑采用“蛤壳”切口(横跨两侧胸腔的胸骨横劈开切口),配合短暂间歇性停呼吸,并将吸入氧浓度保持在40%或更低,以避免肺纤维化风险。处理双侧病灶还可选择分期双侧开胸手术、双侧胸腔镜手术,或经胸骨正中切口在一次手术中切除两肺的病灶(如果都能从同一切口完整切除的话)。胸骨正中切口通常耐受性良好,可避免长时间单肺通气和高氧需求。
共识声明 3.对于肿瘤学条件和身体状况合适的患者,可以考虑实施PM,且应优先选择微创手术方式,以缩短术后恢复时间并减少对短期生活质量的影响。
完全同意:75%;同意:8%;中立:17%;不同意:0%;完全不同意:0%
4.如果通过微创手术无法实现R0切除且保留足够肺实质,而采用开胸手术(开胸切口、胸骨切开或“蛤壳”切口)可以达到上述目标,则开胸手术是适当的选择。
完全同意:83%;同意:17%;中立:0%;不同意:0%;完全不同意:0%
5.除非在多学科管理下经过严格遴选的特殊病例,不建议为达成PM目的而进行全肺切除术。
完全同意:62%;同意:30%;中立:8%;不同意:0%;完全不同意:0%
6.虽然肺转移灶的绝对数量并非PM的直接禁忌症,但PM最佳适用于肺内仅有3个或更少转移灶的患者。
完全同意:33%;同意:42%;中立:8%;不同意:8%;完全不同意:8%
淋巴结处理
在肺外实体肿瘤发生肺转移的患者中,出现肺内转移灶的同时伴有胸腔内淋巴结转移往往预示预后较差。然而,胸外科医生在面对转移性疾病时过去并不常规进行纵隔淋巴结清扫。国际肺转移登记(IRLM)研究包含5206例不同病理类型的患者,报告其中只有5%的患者存在纵隔或肺门LN转移(生殖细胞瘤11%、黑色素瘤8%、上皮性肿瘤6%、肉瘤2%)。该登记研究中仅有4.6%的患者接受了纵隔LN取样。自1997年以来,越来越多的胸外科肿瘤医师在PM手术中进行LN评估,但系统性纵隔淋巴结清扫是否必要仍有争议。欧洲胸外科医师协会2008年的一项调查显示,55%的受访者表示他们会在转移灶切除时常规取样纵隔淋巴结,而33%则避免清扫淋巴结。尽管现有证据表明胸腔内LN状态是PM的重要预后因素,但没有随机研究能够回答纵隔淋巴结清扫是否具有治疗意义。
肺转移灶发生区域淋巴结转移的频率尚不明确,但似乎受肿瘤组织学影响:结直肠癌、乳腺癌和肾癌更高见,肉瘤和黑色素瘤较少发生。尸检系列研究显示,在非肺来源的癌症患者中,33%存在纵隔LN转移。肺转移灶伴纵隔LN转移在结直肠癌中的发生率高于其他上皮性肿瘤,范围报道为12%~44%。多个回顾性系列表明,纵隔LN转移对生存是不利的指标。Hamaji等报告对319例结肠癌PM患者进行了纵隔LN评估,结果显示5年生存率LN阴性组为48%,LN阳性组仅为21%。肺内LN(肺门或纵隔)受累部位的差异是否有影响尚未明确。
值得注意的是,一些研究者提出在转移灶切除之前应行纵隔LN取样,认为最佳实践是如果发现胸腔内有淋巴结转移则不应实施PM。相反的观点认为,LN评估有助于根据不同治疗策略对患者进行分层:例如,接受治愈性PM且LN阴性的患者适合术后密切观察,而LN阳性的患者可能从术后系统治疗中获益。随着更有效的全身疗法的发展,部分患者在全身治疗后病灶缩小、仅残留肺部少量寡残留病灶时,仍可考虑进行PM。
纵隔淋巴结清扫能提高生存率吗? 常规在PM手术中清扫LN的治疗作用尚不明确。现有回顾性系列的研究设计中都缺乏完善的对照组。Winter等对110例肾癌肺转移患者进行了一项配对分析:这些患者在PM时接受了纵隔LN清扫,并与111例未做LN评估的患者进行比较。结果显示行LN清扫的患者生存有改善趋势(p=0.068)。在该研究中,存在胸腔内LN转移的患者其中位生存显著短于无LN转移者(19个月 vs. 102个月,p < 0.001)。
哪些患者应接受纵隔LN清扫? 在考虑进行PM的患者中,如果影像学检查提示可疑的LN,胸外科医生通常会进行纵隔LN清扫。然而,即使用高质量胸部CT和PET检查,也可能漏诊LN转移。Seebacher等报道了209例在PM术前均常规行CT和PET评估的患者,并在手术中行区域LN清扫(158例)或LN取样(112例)。结果这些患者中有17%术中发现了预料之外的胸腔内LN转移,尤其以乳腺癌和肾癌患者多见。鉴于意外LN受累的预后意义,作者建议对所有PM患者常规行LN清扫。
总结: 多次研究的重复观察可以指导实践。由于胸腔内LN转移在多至44%的肺转移患者中发生(而术前CT或PET检查可能出现假阴性),因此在PM手术中同时行系统性LN清扫或取样是合理的做法。即便仅有单个肺转移灶,也可能出现胸腔内LN转移。进一步进行LN评估的理由还包括:帮助向患者解释预后,并判断术后是否需要马上开始辅助治疗,或者对于LN阴性病例是否可以选择观察策略。鉴于数据的缺乏,尚无法针对不同组织类型(上皮性肿瘤、肉瘤、生殖细胞瘤、肾癌和黑色素瘤等)分别制定胸腔内LN评估的具体推荐。
共识声明 7.在进行PM手术时应考虑同期进行LN取样或清扫,因为肺转移灶如伴有纵隔LN转移往往预示患者生存率较低。
完全同意:39%;同意:38%;中立:23%;不同意:0%;完全不同意:0%
肺转移的非手术局部治疗手段
热消融和立体定向放射治疗的作用
本节仅讨论纳入20例以上患者、至少报告3年OS的数据的研究,并主要关注混合病理类型以及结直肠癌或肉瘤肺转移(因这些是报道患者数最多且易于与手术切除研究比较的病种)。尚无针对局部治疗的随机研究。
热消融(Thermal ablation): 热消融技术包括射频消融(RFA)、微波消融和冷冻消融。目前各种系统均有应用,但尚无研究比较不同系统间的差异。虽然大多数中心正逐渐倾向使用微波进行肺消融,但也没有研究比较各种消融方式。需要指出的是,在肺转移治疗的研究中,所有符合纳入标准的研究均采用了射频消融(RFA)方法。
既往研究表明,对于RFA,肿瘤体积越小效果越好。关于肺转移的RFA研究采用的纳入标准差异较大,有的研究纳入了直径高达80 mm的肿瘤。然而,如此大的肿瘤完全消融成功的可能性很低,纳入此类病灶会对结果产生不利影响。
目前规模最大的肺转移消融研究纳入了566例患者,其中293例为结直肠癌肺转移,51例为肉瘤肺转移。该研究表明,在单因素和多因素分析中,原发疾病类型、DFI、转移瘤大小和数量都与OS相关。具体针对结直肠癌肺转移患者分析发现,肿瘤直径>2 cm和转移灶数目>3这两个因素与更差的生存显著相关。
许多肺转移消融研究的一个混杂因素是:仅纳入了内科上无法手术或其他治疗方式失败的患者。尽管如此,其生存结果(见表2)与手术切除后的生存率相当。一项来自澳大利亚的前瞻性开放标签研究报告了148例不可切除的结直肠癌肺转移患者接受RFA的结果:其中位生存期为51个月,5年生存率为45%。关于肉瘤肺转移的研究通常例数较少。在一项包含20例转移灶直径≤2 cm患者的报告中,3年生存率达85%。在上述法国大型研究(566例患者)中,肉瘤患者有51例。尽管该研究纳入的肿瘤最大直径达70 mm,但肉瘤患者的3年生存率仍有58%,这一结果尚属可接受范围。
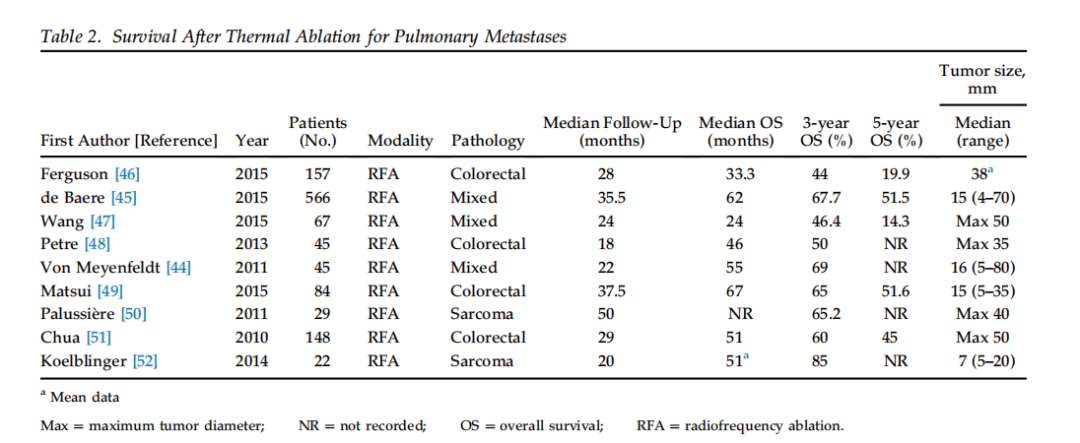
表2. 射频消融治疗肺转移后的生存(部分研究结果) (注:OS=总生存率;DFS=无瘤生存率;NR=未报告)
立体定向消融性体部放射治疗(SABR): SABR(也称SBRT,立体定向体部放疗)用于无法手术的早期肺癌患者已得到广泛应用,其有效性已有报道。因此,一些研究者也尝试将SABR用于肺转移患者。需要注意,本节主要讨论那些因为内科原因无法手术而接受SABR的病例系列。SABR技术通常采用高精度影像引导,在短疗程内给予大剂量辐射,以达到消融肿瘤的目的。不同研究采用的SABR方案不尽相同,但大多基于肺癌的经验。例如,Timmerman等的研究确立了SABR治疗不可手术早期肺癌的安全性和疗效。
对于肺转移患者,越来越多的Ⅱ期研究探索SABR的作用。例如,一项单臂Ⅱ期研究将SABR与厄洛替尼联合应用于少量进展的转移性NSCLC患者,结果显示一定的临床活性。另有研究报道了SABR治疗肺寡转移的结果,包括结直肠癌、软组织肉瘤等。总体而言,SABR治疗肺转移的3年局部控制率通常在50%~85%范围内,3年OS约为40%~60%,疗效似乎与原发肿瘤类型相关:例如结直肠癌、乳腺癌、肾癌的控制率较高,而肉瘤和黑色素瘤则相对较低。一些研究的结果列于表3。
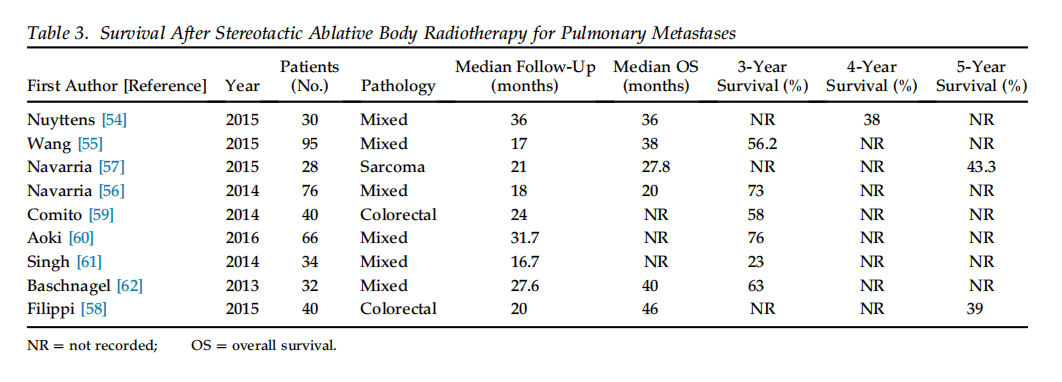
表3. 立体定向体部放射治疗(SABR)肺转移的生存结果(部分研究)
(注:上表数据摘自不同研究,NR=无相关数据)

共识声明 8.热消融或立体定向消融性体部放疗(SABR)是治疗肺寡转移的合理选择,特别适用于因高风险而不宜手术或拒绝手术的患者。
完全同意:58%;同意:25%;中立:8%;不同意:8%;完全不同意:0%
肺灌注在肺转移中的应用
隔离肺灌注术(ILP)是一种外科技术,通过选择性阻断肺循环来向肺组织局部灌注大剂量化疗药物,从而降低系统毒性。具体而言,该技术经肺动脉选择性灌注化疗药,并回收含药静脉血,避免药物全身分布。ILP的理论优势在于能够向肺部提供极高剂量药物,同时降低重要脏器的暴露,从而避免严重并发症。此外,ILP还能减少药物经肾脏代谢清除造成的有效浓度丢失。肺被认为是适合隔离灌注的理想器官,因为其结构对称,动脉供应单一来自肺动脉,静脉回流经两条肺静脉汇入心房,而且肺组织能够耐受高温而不明显影响全身功能。Johnston等从1983年开始研究ILP,在动物实验中考察了阿霉素在ILP时的毒性和药代动力学,以及高温对肺功能和阿霉素摄取的影响。
目前有两种ILP灌注方式:单循环灌注和循环灌注。单循环灌注是指让含化疗药物的血液通过肺组织一次后即弃去回收的静脉血;循环灌注则是将回收的血液重新导回肺循环,进行多次循环。技术上的变化还包括前向(顺行)灌注与逆向灌注、血流阻断技术、血管内阻断、延迟开放夹闭,以及选择性血管内肺动脉灌注等。
1995年,Pass等开展了一项I期临床试验,将TNF-α和IFN-γ用于15例患者的ILP以评估安全性和可行性。结果在术后8周内观察到3例部分缓解,但在术后7~9个月时同侧新出现结节或病灶再增大。所有患者未经灌注的一侧肺在术后8周时疾病均稳定或恶化。这提示ILP虽可取得一定近期效果,但持久控制欠佳。
1996年,Ratto等对6例肉瘤肺转移患者实施了以顺铂为基础的ILP。手术均顺利完成,无术中或围术期死亡。6例中2例在术后出现“肺挫伤综合征”即影像学上出现间质和肺泡水肿征象。中位随访13个月时,6例患者中4例无病生存,1例死于肺外转移,1例出现远处复发。所有患者均未发生化疗药物的系统毒性。此外,他们还对2例双肺转移患者分两次手术进行了ILP,证明对双侧先后进行ILP是安全可行的。
另一项由Schröder等进行的研究纳入4例肉瘤肺转移患者,采用高剂量顺铂联合42℃热疗进行ILP,其中2例为双肺病变。结果随访12个月时3例存活且无病,另1例死于脑转移,但肺内无复发。
Burt等开展了一项ILP应用阿霉素治疗不可切除肉瘤肺转移的I期试验。8例入组患者中7例接受了≤40 mg/m²剂量的治疗,1例接受了80 mg/m²剂量。无围手术期死亡,但28个月随访中有6例患者死于疾病进展。遗憾的是,没有患者对治疗产生部分或完全缓解。仅1例患者肺内病灶稳定,与对侧肺相比灌注侧的病灶未见进展。
2004年,Hendriks等开展了一项应用美法仑ILP的I期试验。16例患者分成8组,每组方案不同,这些患者均为对美法仑敏感肿瘤的肺转移。无手术相关死亡。2例患者接受60 mg剂量、37℃温度的美法仑ILP后出现肺水肿,X线表现类似化学性肺炎。长期随访中,16例中7例复发;其中4例出现肺外复发,1例在先前灌注过的肺内复发。
ILP并发症主要局限于肺部,可出现一过性的放射性肺炎、肺水肿、用力肺活量和一氧化碳扩散量下降等。除报道过有阿霉素相关的心脏毒性外,几乎未见显著的全身毒性。
尽管少数I期临床试验表明ILP在人类可行且安全,但疗效结果不尽如人意,大多数患者长期生存率较低。随着新型生物靶向治疗和免疫治疗的发展,是否应继续推进ILP的临床研究存在争议。
共识声明 9.在临床研究以外,不推荐采用隔离肺灌注(ILP)来治疗肺转移瘤。
完全同意:75%;同意:17%;中立:8%;不同意:0%;完全不同意:0%
各种肿瘤类型的肺转移管理
结直肠癌
一项基于美国SEER数据库的研究发现,大约5%的结直肠癌患者在初始分期时即有肺转移。直肠癌出现肺转移的发生率(5.6%)高于结肠癌(3.7%)。其他研究报告结直肠癌发生肺转移的总体发生率约5%~15%,其中包括异时性转移在内。实际上,在所有结直肠癌患者中,只有一小部分最终发展出了肺转移。然而,由于结直肠癌总体发病率高,其肺转移的管理仍是肿瘤学上的一大挑战。
传统上,对于结直肠癌患者,PM手术的目标在于追求治愈,因为一般而言一旦出现转移,疾病即被认为无法治愈。例如,Hou等报告了结直肠癌肺转移患者接受包括PM在内的综合治疗后的生存情况:不论采用胸腔镜手术还是开放手术,患者的生存曲线在长期随访中均出现平台期,5年OS分别为50%和46%(p=0.251),二者差异无统计学意义。两组患者的5年无瘤生存率均约为35%~40%。
临床数据与PM: 患者选择是结直肠癌PM文献的核心问题。各中心通常基于可切除性及患者能够耐受手术这两个前提来考虑是否进行PM。能够预测患者癌症复发风险更低或寿命更长的特征会使医生倾向考虑转移灶切除。Treasure等人在2014年总结了IRLM这一标志性研究的发现:在IRLM中,结直肠癌是最常见的原发病。研究发现,不利预后与多发转移灶、癌胚抗原(CEA)升高、以及原发切除至转移出现的间隔短或无间隔(即同步转移)等因素相关。
2013年发表的一项系统评价和荟萃分析总结了结直肠癌PM术后生存的危险因素。该分析纳入了2000年以后发表的25项研究、约3000例患者。结果确定了4个与生存不良相关的因素: 1.原发肿瘤切除至肺转移出现的无瘤间隔期较短(风险比HR=1.59,95% CI 1.27~1.98); 2.肺转移灶数目多(HR=2.04,95% CI 1.72~2.41); 3.肺门或纵隔淋巴结受累(HR=1.65,95% CI 1.35~2.02); 4.术前CEA升高(HR=1.91,95% CI 1.57~2.32)。
有意思的是,其他一些后续的手术系列研究并未一致证实上述所有因素。例如,有的报道认为DFI并非预后显著因素,但总体上上述4点被广泛认为是重要的考虑因素。
已有大量关于结直肠癌肺转移PM的研究发表(估计有数百篇),但都存在前述局限。2010年的一项总结分析了来自11篇文献的1300余例PM患者,其中4篇包含了淋巴结阳性患者。总的来说,这些研究仍不足以确定PM的真正价值。英国PulMiCC研究(一项针对结直肠癌肺转移切除的随机试验,注册号NCT01106261)已经完成了可行性阶段,入组70例患者,但完整结果尚未发表 。这项研究有望为这一问题提供更高水平的证据。
目前有关结直肠癌肺转移的管理指导主要依据专家共识和相关领域的类推。例如,III期结肠癌根治术后辅助化疗可提高DFS和OS,高危II期结肠癌亦可能从中获益。鉴于IV期结直肠癌即使经过完全切除,复发风险更高,类似地,人们推测在肺转移切除的背景下使用与III期相同方案的氟尿嘧啶类±奥沙利铂辅助化疗可能有益。一项大型RCT(EORTC 40983研究)显示,对于可切除肝转移的结直肠癌患者,围手术期使用FOLFOX方案可延长无瘤生存期,尽管更长期随访未见OS获益。因此,对于肺转移,是否采用术前/术后全身治疗仍缺乏直接证据支持,需要依据个案特点由MDT讨论决策。英国国家卫生与临床优化研究所(NICE)曾针对结直肠癌肺转移的手术角色提出指南,强调需由MDT评估决定,并推荐系统治疗应作为初始治疗。
共识声明 10.对于结直肠癌患者,可在多学科团队(MDT)框架下考虑肺转移瘤切除术(PM),并在PM手术前后结合全身治疗。
完全同意:92%;同意:8%;中立:0%;不同意:0%;完全不同意:0%
肾细胞癌
大约1/3的肾细胞癌患者在确诊时即存在同步转移。一系列191例患者的研究显示,如果能够达到R0切除,则采用胸腔镜或开放手术方式对长期生存没有影响。手术切除范围从楔形切除到肺叶切除不等,但以肺楔形切除为主。报道的围术期30天病死率为0%~2.1%不等。由于许多研究纳入了辅助化疗、免疫治疗或肺外转移切除的数据,单纯评价手术的生存益处较为困难。过去15年的报告显示,中位生存期为21~44个月不等(见表4)。
研究考察的特定预测因素包括:完全切除与否、无瘤间隔期(DFI)的长短、转移灶数量与大小、肺内转移部位、患者年龄、肿瘤组织级别和性别等。Hofmann等的研究中,如果切除不完全,无一患者生存超过5年,而完全切除者5年生存率为39%。他们还报告了按转移灶数量分组的5年生存率:单灶为54.7%,2~6个灶为32%。日本某单中心对25例患者10年的系列报道显示,总体3年生存率为53%,5年生存率为35.5%,中位生存期34个月。令人意外的是,该系列中DFI、病灶位置和数量以及切除完全性均非显著的预后因素。另一项对105例患者的多因素分析也发现转移灶数量并非重要因素,但淋巴结受累是预后不良因素。
另有一家意大利中心回顾了1973~2008年期间48例患者,报告的中位生存为39个月,3年生存率60%,5年47%,10年18%。Mayo Clinic的一项研究涉及多个转移部位,结果显示切除的完整程度具有预后意义:不能完全切除肺转移会显著降低5年生存率(从73.6%降至12.95%)。类似地,Cleveland Clinic在2005年的报告指出完全切除将5年生存率从8%提高到了42%。在两个系列(105例和191例患者)中,完全切除以及转移灶大小均是重要的生存预后因素。
有研究指出患者年龄是一个正向的预后指标。某系列报道显示,>60岁患者的5年OS为70%,而≤60岁患者为37%。类似地,一些研究发现老年患者生存更好,原因尚不明(可能与生物学行为有关)。性别和肿瘤组织级别在1985~1999年的德国系列中则没有表现出显著的预测作用。总体而言,这些研究支持:对于肾癌肺转移患者,如果能够完整切除转移灶,则应考虑手术。
共识声明 11.对于肾细胞癌患者,可在多学科团队(MDT)框架下考虑肺转移瘤切除术(PM)。
完全同意:92%;同意:8%;中立:0%;不同意:0%;完全不同意:0%
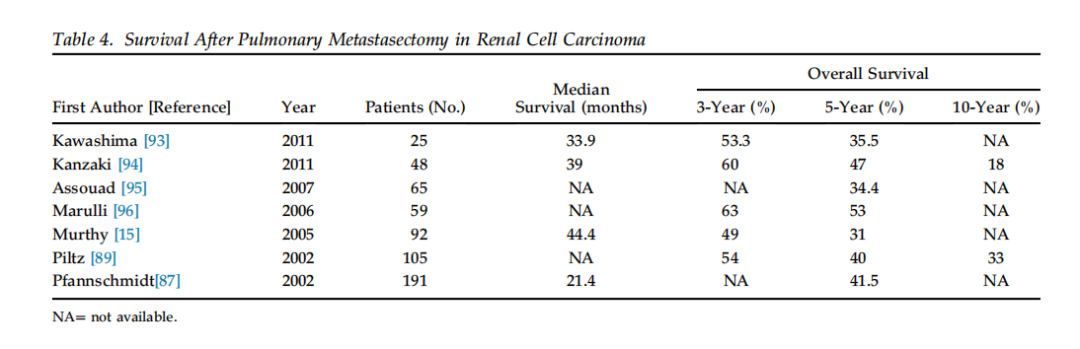
表4. 肾细胞癌肺转移瘤切除术后的生存情况
注:表中“未报告”表示文献未提供该数据。
恶性黑色素瘤
初次治疗后约30%的恶性黑色素瘤患者会发生转移。在大样本研究中,30%~40%的黑色素瘤患者在病程中出现肺转移。大规模分析显示,在有内脏转移的1158例黑色素瘤患者中,仅出现肺转移者比出现其他内脏转移者生存更长。对于IV期疾病,系统治疗仍是主体,但传统化疗和IL-2治疗的毒性大且疗效令人失望。IRLM于1998年发布的历史数据显示,黑色素瘤晚期患者行PM后的结局是所有病种中最差的,与生殖细胞瘤、上皮性肿瘤和肉瘤相比预后最差。在该手术系列(n=328)中,黑色素瘤复发概率为64%,其中73%的复发发生在肺外器官。尽管过往报道显示晚期黑色素瘤预后极差,但自2011年以来,免疫检查点抑制剂显著提高了生存:某些亚组患者2年生存率可达60%。对2011~2014年期间441例IV期黑色素瘤患者的分析显示,如果将转移瘤切除作为首选治疗,其OS最佳。
过去几十年的一些手术系列表明,选择性切除远处转移(包括肺转移)可以获得长期生存,有报道可达到5年生存率20%~30%。多项研究调查了PM在晚期黑色素瘤中的作用,报告的5年生存率多在20%左右。然而,需要注意的是,这些回顾性研究的时代背景下尚无现代免疫和靶向治疗。一些研究指出:在对全身治疗部分响应但肺部残留病灶未完全消退的黑色素瘤患者,切除残余肺转移可能有帮助,主要基于个案的报道。
考虑到当前免疫治疗在黑色素瘤中的突出地位,对于选定的病情控制良好且仅肺部残留寡转移病灶的患者,可以考虑PM作为使患者达到无瘤状态的巩固疗法。然而,由于缺乏前瞻性数据,临床中应严格选择患者,包括考虑原发病控制情况、无瘤间隔期长短以及患者总体状况。总体而言,在现代治疗模式下,黑色素瘤患者接受PM的角色仍未完全明确,需要进一步研究。
共识声明 12.对于恶性黑色素瘤患者,可在多学科团队(MDT)框架下考虑肺转移瘤切除术(PM)。
完全同意:75%;同意:25%;中立:0%;不同意:0%;完全不同意:0%
肉瘤
在约20%~40%的软组织肉瘤患者中,病程中会发生转移,其中肺是最常见的首发内脏转移部位(高达80%以上)。由于化疗对肉瘤的疗效有限,PM已成为这类患者公认甚至优选的治疗方式。然而总体而言,肉瘤肺转移患者行PM术后的5年生存率仅30%~50%。许多患者会出现肺部复发,一些研究报告多次肺转移切除可能带来一定益处。
软组织肉瘤的肺转移切除术结果各研究差异较大,但一般显示5年生存率在20%~40%之间。影响预后的因素包括原发肿瘤大小、分化程度、转移灶大小和数量、DFI等。不完全切除显著缩短生存。由于病例数相对较少,各研究难以得出统一结论。一些来自多中心或国家数据库的研究正在累积经验,以更好地回答哪些肉瘤患者能真正从肺转移切除中获益。
总体来说,对于软组织肉瘤肺转移,如果患者没有其他转移灶且能够耐受手术,切除肺转移灶是目前认可的管理方式。反复切除复发的肺转移对于部分患者也可考虑,但需慎重评估收益与风险。术后辅助治疗在肉瘤中的作用尚不明确,有时会根据原发肉瘤的类型考虑是否给予进一步治疗。
共识声明 13.对于肉瘤患者,可在多学科团队(MDT)框架下考虑肺转移瘤切除术(PM)。
完全同意:92%;同意:8%;中立:0%;不同意:0%;完全不同意:0%
头颈部肿瘤
虽然头颈部鳞状细胞癌(HNSCC)发生远处转移的概率较低,且与局部控制和淋巴结状态密切相关,但在发生转移的情况下70%~85%会累及肺部。决定性影响因素包括患者年龄、原发灶部位以及手术切除的完整程度等。1992年Finley等报道了18例头颈部癌肺转移患者行手术的结果:DFI <1年者无一例生存5年,因此作者认为DFI短于1年者不应考虑手术;而DFI长于1年者有潜在获益。此后,许多研究试图鉴别哪些头颈部肿瘤患者从肺转移切除中获益。总体来看,若患者在原发肿瘤控制后长期无瘤且仅出现孤立肺转移,且无纵隔淋巴结转移,则手术可能有意义。
值得注意的是,原发肿瘤病理不同,其肺转移切除后的预后有差异。例如,一项比较鳞癌与腺样囊性癌等腺体来源肿瘤的研究显示,后者切除肺转移后的5年生存率为64%,而鳞癌仅34%。但需要指出,这其中鳞癌组的患者有其他混杂因素(如更多患者存在同时的区域淋巴结转移)。
总体而言,对于头颈部鳞癌,假如患者原发灶治疗后一年以上无病、生理状态良好,且肺转移灶可完全切除且没有其他转移,则可考虑手术。纵隔或肺门淋巴结转移一旦存在,则预后较差,手术价值值得商榷。头颈部其他组织来源的肿瘤(如腺样囊性癌、甲状腺癌等)的肺转移情况相对少见,这里不展开讨论。
共识声明 14.在头颈部肿瘤的治疗中,当无瘤间隔期超过12个月、肺转移灶可完全切除且无淋巴结转移时,可以考虑实施肺转移瘤切除术(PM)。
完全同意:42%;同意:42%;中立:8%;不同意:8%;完全不同意:0%
非精原性生殖细胞肿瘤(NSGCT)
经血行播散,肺是非精原性生殖细胞肿瘤最常见的内脏转移部位。与其他实体瘤不同的是,睾丸来源的非精原性生殖细胞肿瘤发生肺或纵隔转移即归类为AJCC III期疾病。治疗模式上,通过含铂化疗继之以手术清除残余病灶的综合治疗,被视为多学科治疗最成功的范例之一。关于化疗后是否行肺转移灶切除(PM)的决策需要考虑多种因素,包括肿瘤标志物和影像反应情况、睾丸切除术后病理中是否有畸胎瘤成分、以及(如已施行)化疗后后腹膜LN清扫(RPLND)的病理结果,因为RPLND的病理与肺部残余病理存在高度相关性。若化疗后血清甲胎蛋白和β-HCG仍升高,则高度提示有存活的非精原性成分。在大多数患者中,首次含铂化疗后肿瘤标志物(STM)能够恢复正常,这通常表示非精原性成分已被清除,只剩下“良性”的残余(如坏死或成熟畸胎瘤)。如果化疗后STM仍持续升高,则通常给予二线含铂化疗,必要时甚至行大剂量化疗联合自体干细胞移植。
许多III期患者经过化疗后,肺部转移灶将完全消退或仅遗留极小的残余结节(<10 mm)。对于这些结节,通常采取观察策略。估计约有10%~20%的NSGCT患者在一线化疗后仍遗留肺部残余病灶或在随访中出现肺部新病灶,这些情况需要考虑行PM。其中大约一半的患者还存在残余纵隔疾病需要切除,这一点在制定手术计划时应考虑。遗憾的是,目前尚无准确模型能够区分化疗后肺部残余病灶是完全坏死还是仍有活性肿瘤。一般认为,如果睾丸或后腹膜淋巴结病理中含有畸胎瘤成分,且化疗后STM正常,则肺部残余结节很可能是畸胎瘤或坏死。一些CT影像特征(如结节呈圆形或囊性)也提示可能是畸胎瘤。虽然畸胎瘤被视为“良性”,但它有局部生长潜能,亦可发生恶性转化,因此建议手术切除,并且术后治愈率很高。手术过程中采用尽量保留肺组织的手法剥除畸胎瘤,可以避免不必要的大范围肺切除。如果一侧肺PM手术病理证实完全坏死,那么对侧肺的异常结节可以选择观察,因为两侧肺病理结果的一致性高达90%。较少见的情况是,残余病灶中有持续存在的非精原性癌或畸胎瘤的恶性转化,此时通常可通过STM升高或睾丸/后腹膜病理提示而预见到。对于这类情况,可在严格挑选的患者中考虑手术切除少量残余病灶来尝试治愈,但其治愈率明显低于畸胎瘤患者。与代谢低的畸胎瘤不同,对于怀疑存活恶性成分的患者,PET影像可能有助于判断哪些病灶需要切除。手术通常采用标准楔形切除,只有在极少数情况下需要解剖性肺切除以确保获得足够切缘。
总体而言,经过含铂化疗后的睾丸非精原性生殖细胞肿瘤患者,如果行PM,其治愈潜力很高。不同系列报道的5年生存率范围为59%~94%。尽管缺乏前瞻性随机研究,但PM后的高治愈率使得临床上对手术有强烈倾向。预后因素包括患者初诊时的国际生殖细胞肿瘤协作组风险分层(低危、中危或高危),以及化疗后切除病灶的病理(良性:坏死/畸胎瘤,或恶性:存活的NSGCT/畸胎瘤恶性转化)等。
共识声明 15.在治疗非精原性生殖细胞肿瘤(NSGCT)时,对于经含铂化疗后残留的所有≥10 mm肺部异常病灶、患者血清肿瘤标志物已恢复正常且怀疑其中含有畸胎瘤成分的情况,均应进行肺转移瘤切除术(PM)。
完全同意:67%;同意:25%;中立:8%;不同意:0%;完全不同意:0% 16.在治疗NSGCT时,如果一侧肺PM手术的组织学结果显示完全肿瘤坏死,则对对侧肺的异常病灶可以选择观察。
完全同意:46%;同意:46%;中立:8%;不同意:0%;完全不同意:0% 17.在治疗NSGCT时,对于经一线或二线含铂化疗后仍残存少量肺部异常病灶、怀疑其中含有存活的非精原性癌细胞或畸胎瘤恶性转化成分(或两者)的特定患者,应考虑实施肺转移瘤切除术(PM)。
完全同意:67%;同意:33%;中立:0%;不同意:0%;完全不同意:0%
乳腺癌
乳腺癌患者发生肺转移的比例约为7%~24%。对大多数乳腺癌患者而言,进行转移灶切除术(metastasectomy)的初衷主要是为了明确诊断、检测激素受体状态,以及排除其他原发癌或其他转移癌。因此,在乳腺癌肺转移的管理中,PM作为治疗手段仍存在争议。乳腺癌肺转移通常被视为全身性疾病,目前尚无明确证据支持PM可用于治疗目的。然而,尽管普遍遵循系统治疗为主的模式,一些回顾性研究提示对于高度选择的乳腺癌患者,针对孤立或有限肺转移行PM可能带来生存获益。一项对16篇研究共1937例乳腺癌PM患者的荟萃分析显示,其5年生存率为46%。预后不良的因素包括:DFI <3年、切除不完全、转移灶数量>1,以及激素受体阴性。相比之下,一系列仅接受化疗(无手术)的乳腺癌肺限局转移患者,其5年生存率仅16%。与其他实体瘤类似,多发或双侧乳腺癌肺转移行PM预后较差。一项对81例乳腺癌转移患者的报告强调了这一点:仅有单一转移部位的患者较多转移部位者OS显著延长(103个月 vs. 37个月)。另有报道指出,手术方式(开胸或胸腔镜)和切除范围(楔形或肺叶切除)对长期生存无显著影响,只要达成R0切除即可。
由于很多有关IV期乳腺癌合并肺转移的研究中,患者同时接受了全身治疗(内分泌、化疗或靶向治疗),因此很难明确PM对长期生存的独立贡献。Staren等比较了仅内科治疗与内科治疗加手术两组患者,发现加做PM的患者生存显著改善(34个月 vs. 58个月),5年生存率从11%提高至36%。另一项467例乳腺癌PM患者的研究中,术前或术后化疗对OS无明显影响。
有证据表明:对于激素受体阳性(包括ER阳性或HER2阳性)的乳腺癌患者,进行PM较受体阴性者有更大生存优势,其5年生存率分别为77% vs. 12%。如果伴有纵隔LN转移,则预后较差。然而,一篇近期综述指出:鉴于目前乳腺癌转移患者预后已有所改善,PM所增加的价值仍不清楚。
共识声明 18.对于乳腺癌患者,可在多学科团队(MDT)框架下考虑肺转移瘤切除术(PM)。
完全同意:58%;同意:33%;中立:8%;不同意:0%;完全不同意:0%
结论
目前,对于癌症患者管理中的肺转移瘤切除术,尚不能确定绝对的最佳实践。与肿瘤治疗其他领域类似,临床医师应尽可能遵循循证的临床标准,并避免陷入“能做就去做”的思维陷阱。在肿瘤治疗的许多方面,医学的艺术成分仍占有一席之地。理想情况下,不断地审阅最新肿瘤学文献、熟悉各国家和学会的指南建议、采用MDT协作以及共享决策的方式,能够为临床诊疗提供框架,即使无法获得纯粹基于证据的方案。
|